 设为首页
设为首页
 加入收藏
加入收藏
第三课时
教学目标
1、掌握元素周期律的涵义和实质
2、了解元素周期律的应用
重点难点
元素周期律的应用
教学过程
[引言]从前面的学习,我们可以认识到:我们知道,元素在周期表中的位置,由元素原子的结构决定,而元素原子的结构又决定了元素的性质,即元素的性质是元素在元素周期表中的位置的外在反映。那么研究元素周期表和元素周期律有何意义呢?
[板书]三、元素周期表和元素周期律的应用
[教师]我们首先从元素的金属性和非金属性、元素的化合价两方面来研究元素的性质与元素在周期表中位置的关系。(中学化学里我们主要研究主族元素)
[板书]1.元素的金属性和非金属性与元素在周期表中位置的关系
[教师]请大家观察附录中的元素周期表。
[学生活动]
[提问]元素周期表中的表格底色有几种?为什么要这样表示?
[学生]底色有两种,绿色和浅绿色。可以使我们很明显地区别出金属元素和非金属元素.
[教师]回答得很好。而且,从表上我们可以看出,元素周期表中,金属元素和非金属元素的区域特别集中,沿着周期表中硼、硅、砷、碲、砹跟铝、锗、锑、钋之间画一条线,线的左面是金属元素,右面是非金属元素。由于元素的金属性和非金属性之间没有严格的界线,因此,位于分界线附近的元素,既能表现出一定的金属性,又能表现出一定的非金属性。在周期表中,主族元素从上到下从左到右,元素的金属性和非金属性存在着一定的递变规律。我们可以把以上的内容用以下形式简要地表示出来。
[投影]
元素金属性和非金属性的递变
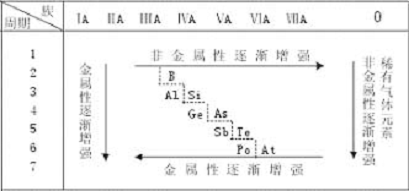
[板书]
(1)同一周期从左到右元素的金属性逐渐减弱,非金属性逐渐增强(不包括稀有气体元素)。
(2)同一主族从上到下元素的金属性逐渐增强,非金属性逐渐减弱(不包括稀有气体元素)。
[教师]请大家根据我们上面学过的知识,参考元素周期表,分析除稀有气体元素外,在周期表中什么元素的金属性最强?什么元素的非金属性最强?为什么?
[学生]根据同周期同主族原子半径的变化规律可知,在周期表中,钫(Fr)元素的原子半径最大,氟(F)元素的原子半径最小,因此,钫元素的失电子能力应是最强的,钫元素的金属性也就最强;氟元素的得电子能力最强,氟元素的非金属性也就最强。
[教师]很正确。氟元素也是自然界中存在的非金属性最强的元素,钫及其后面的元素均是放射性元素,在自然界稳定存在的元素当中,铯(Cs)的金属性是最强的。
[过渡]元素的化合价指的是该元素的原子和其他元素一定数目的原子化合时所表现出来的一种性质。那么,它与元素在周期表中的位置有何关系呢?下面我们就来探讨这个问题。
[板书]2.元素化合价与元素在周期表中位置的关系。
[讲述]元素的化合价与原子的电子层结构,特别是与最外电子层中电子的数目有密切关系,因此,元素原子的最外电子层中的电子,也叫做价电子。另外,有些元素的化合价与它们原子的次外层或倒数第三层的部分电子有关,这部分电子也叫价电子。下面,我们主要来研究主族元素的化合价与其在周期表中位置的关系。
[教师]请填写下表的空白处
[投影]
|
主 族 |
ⅠA |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
|
元素符号 |
Na |
Mg |
Al |
Si |
P |
S |
Cl |
|
最外层电子数 |
|
|
|
|
|
|
|
|
最高正价 |
|
|
|
|
|
|
|
|
最低负价 |
|
|
|
|
|
|
|
[学生回答,教教师填写]
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
|
+1 |
+2 |
+3 |
+4 |
+5 |
+6 |
+7 |
|
|
|
|
-4 |
-3 |
-2 |
-1 |
[提问]根据上表回答,主族元素的族序数与元素原子的最外层电子数及最高正化合价有什么关系?
[学生]相等。
[教师]据此,我们有以下结论:
[板书]主族序数=最外层电子数=主族元素最高正价数
[教师]其中,有个别元素比较特殊,如氧元素的化合价一般是-2价,而氟元素没有正化合价。
[提问]非金属元素的最高正价和最低负价的绝对值之和有什么规律?
[学生]等于8。
[教师]这样,我们可以得到以下关系,即:
[板书]|最高正价|+|最低负价|=8
[教师]金属元素只有正化合价而无负价。
[投影练习]
1.主族元素的最高正化合价一般等于其 序数,非金属元素的负化合价等于 。
答案:主族 8-主族序数或8-最高正价
2.卤族元素的原子最外层上的电子数是 ,其中,非金属性最强的是 。卤素的最高价氧化物对应水化物的化学式是 (以X表示卤素)。
答案:7 F HXO4
[注:教教师需补充说明,氟元素无最高价氧化物及其水合物,因为氟元素无正化合价]
3.填表
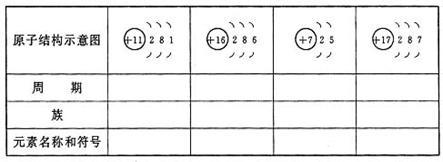
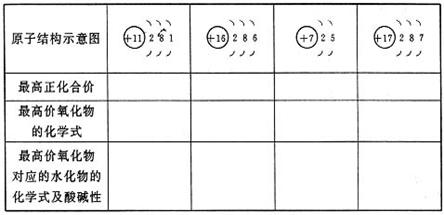
答案:略
[教师]从上面的学习,我们可以认识到:元素在周期表中的位置,反映了该元素的原子结构和一定的性质。因此,可以根据某元素在周期表中的位置,推测它的原子结构和某些性质;同样也可以根据元素的原子结构,推测它在周期表中的位置及性质。我们可以用下图来表示它们之间的这种关系。
 [板书] 元素性质
[板书] 元素性质
![]() 原子结构 周期表中的位置
原子结构 周期表中的位置
[教师]这样,我们就可以利用元素的性质,它在周期表中的位置和它的原子结构三者之间的密切关系,来指导我们对化学的学习和研究。这也是元素周期律和元素周期表的意义所在。那么,元素周期律和周期表的意义是不是仅限于此呢?请大家阅读课本P17有关周期律的内容,并进行总结。
[学生活动]
[教师]由我们所阅读的内容,可得出元素周期律及元素周期表的其他应用,主要表现在以下几个方面:
[投影板书]1.是学习和研究化学的一种重要工具。
2.为新元素的发现及预测它们的原子结构和性质提供了新的线索。
3.启发人们在周期表中一定的区域内,寻找新的物质。
[教师]请大家分别举例说明。
[学生甲]如我们学习碱金属时,主要是以Na为代表物来学的,而铷、铯却没有见过,但我们可根据其在元素周期表中的位置及与Na的相对位置判断出其还原性比钠强,其形成的碱的碱性比强碱NaOH还要强。
[学生乙]我们还可以预见,铷和铯与水的反应一定剧烈得很,所以,做实验时首先要做好安全保护工作。
[学生丙]人们为113、115、117号元素留下了空位,并根据其相邻元素的性质去发现和研究它们。
[学生丁]根据农药多数是含F、Cl、S、P等元素的化合物,而在一定区域内寻找新的农药。
[学生戊]在周期表里金属与非金属的接界处寻找半导体材料,如Ge、Si、Ga、Se等。
[学生己]在过渡元素中寻找催化剂和耐高温、耐腐蚀的合金材料。
……
[教师]大家回答得很好。除此以外,元素周期律和周期表在自然科学的许多部门,如化学、物理学、学生物学、地球化学等方面,都是重要的工具!
[小结]本节课我们重点学习了元素的性质与元素在周期表中位置的关系,并了解了它们的意义所在,希望大家在以后的化学学习中,能很好地运用元素周期表来指导我们的学习,并使它成为我们学习中的益友。
巩固练习:
1.下列性质的递变中,正确的是( )。
A.O、S、Na的原子半径依次增大
B.LiOH、KOH、CsOH的碱性依次增强
C.HF、NH3、SiH4的稳定性依次增强
D.HCl、HBr、HI的还原性依次减弱
2.某元素X的原子序数为52,下列叙述正确的是( )。
A.X的主要化合价是-2、+4、+6
B.X可以形成稳定的气态氢化物
C.X的最高价氧化物对应水化物的酸性比HBrO4的酸性强
D.X原子的还原性比碘原子强
3.已知铍(Be)的原子序数为4。下列对铍及其化合物的叙述中,正确的是( )。
A.铍的原子半径大于硼的原子半径
B.氯化铍化学式中铍原子的最外层电子数是8
C.氢氧化铍的碱性比氢氧化钙的弱
D.单质铍跟冷水反应产学生氢气
4、X、Y是元素周期表中Ⅶ A族中的两种元素。下列叙述中能说明X的非金属比Y强的是( )。
A.X原子的电子层数比Y原子的电子层数多
B.X的氢化物的沸点比Y的氢化物沸点低
C.X的气态氢化物比Y的气态氢化物稳定
D.Y的单质能将X从NaX的溶液中置换出来
5、下表是元素周期表的一部分:
|
族周期 |
ⅠA |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
|
1 |
① |
| |||||
|
2 |
② |
③ |
④ |
|
⑤ |
⑥ |
|
|
3 |
|
⑦ |
⑧ |
|
|
⑨ |
⑩ |
(1)表中元素⑩的氢化物的化学式为 ,此氢化物的还原性比元素⑨的氢化物的还原性 (填强或弱)。
(2)某元素的核外P电子数比S电子数少1,则该元素的元素符号是 ,其单质的电子式为 。
(3)俗称为“矾”的一类化合物通常含有共同的元素是 。
(4)已知某些不同族元素的性质也有一定的相似性,如元素③与⑧的氢氧化物有相似的性质。写出元素③的氢氧化物NaOH 溶液反应的化学方程式 ,又如表中与元素⑦的性质相似的不同族的元素是 (填元素符号)。
参考答案:1、AB 2、AD 3、AC 4、C
5、(1)HCl,弱![]()
(2)N,
(3)O、S
(4)Be(OH)2+2NaOH===Na2BeO2+2H2O,Li
|