 设为首页
设为首页
 加入收藏
加入收藏
教材分析:
将旧教材中的阅读教材“非极性分子和极性分子”提升为新教材中的“第五节 非极性分子和极性分子”,它是化学键内容的延伸、巩固与应用。本节教材只要求学生掌握常见分子的极性与非极性,不宜过多扩展。新教材将旧教材中“第七节 离子晶体、分子晶体和原子晶体”调整为高三化学内容。这样处理既降低了难度,又分散了难点,体现了减负的精神。
本节教材分三部分内容。
第一部分介绍键的极性,是对共价键认识的进一步加深。由于考虑到成键原子吸引电子能力的大小和共用电子对在成键原子间的位置,会自然产生疑问,而教材恰好回答了这个问题,引出极性键和非极性键的概念。
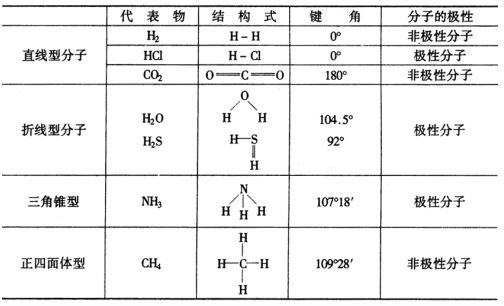
第二部分介绍分子的极性。分子的极性与键的极性和分子的空间构型有关。教材中回避键角的概念,而是用两个键之间的夹角来表达。
第三部分介绍了分子间作用力。教材从气体在一定条件下转变成液体或者固体的实验事实说明存在分子间作用力。指出它比化学键要弱得多,对物质的熔点、沸点、溶解度等有影响。
最后教材中还安排了家庭小实验,让学生亲自动手制作简单分子模型,有助于培养学生的空间感。
本节教学重点:非极性分子和极性分子。
教学难点:分子结构和分子极性的关系。
教法建议
在上一节研究共价键的形成和特点之后,必然要考虑成键原子对共用电子对吸引能力的大小,以及共用电子对在成键原子之间的位置。通过引导学生判断电子对在分子里的偏移程度,可加深对离子键和共价键的认识。
1.关于非极性键和极性键的教学
实验导入:用毛皮摩擦玻璃棒分别靠近CCl4液流和H2O流,观察现象。
提出问题:
(1)水流偏移的原因是什么;
(2)为什么在氢气分子结构中,电子对不偏向任何一个原子;
(3)在氯化氢分子结构中为什么电子对偏向氯原子。通过讨论小结,形成极性键和非极性键的概念。
(4)H–X 键中哪个极性最强?键的极性与什么因素有关?通过讨论,明确键的极性与成键元素的非金属性有关。
2.关于非极性分子和极性分子的教学
分析H2、HCl的分子结构,得出分子也有极性与非极性之别。从键的极性的角度来给非极性分子和极性分子下定义。通过讨论,明确判断分子极性的方法。
在讲分子空间结构时,可借助计算机、多媒体进行动画处理,这会有助于培养学生的空间观念。还可以鼓励学生自己动手制作分子模型。
3.关于分子间作用力的教学
从水的三态变化引入,说明分子间存在着作用力;通过比较水汽化和分解的温度,说明分子间作用力较弱;通过分析卤素单质的状态由气态变为液态、固态的原因,了解分子间作用力的规律。
分子间作用力
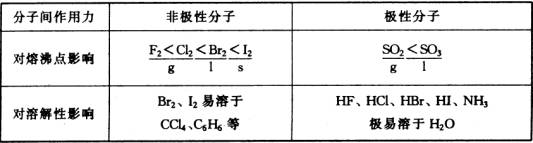
(1)卤素单质结构相似,随分子量增大熔沸点升高。
(2) ![]() 和
和 ![]() 都是极性分子,分子量增大,熔沸点升高。
都是极性分子,分子量增大,熔沸点升高。
(3)极性分子难溶于非极性分子。如 ![]() 等难溶于
等难溶于 ![]() 。
。
(4)非极性分子难溶于极性分子。如汽油、 ![]() 等难溶于水。
等难溶于水。
(5)离子化合物易溶于水,难溶于有机溶剂。
分子极性的判断方法
分子的极性的判断方法是:①单质分子均为非极性分子②双原子分子键的极性与分子的极性一致③多原子分子如 ![]() 型,若中心原子A中没有孤对电子,为非极性分子,中心原子A中有孤对电子,则为极性分子。这是因为孤对电子对邻近的电子对的斥力较大,就会把成键电子对斥向一方,从而正负电荷重心不重合显示出极性来。
型,若中心原子A中没有孤对电子,为非极性分子,中心原子A中有孤对电子,则为极性分子。这是因为孤对电子对邻近的电子对的斥力较大,就会把成键电子对斥向一方,从而正负电荷重心不重合显示出极性来。
说明:孤对电子即未参与成键的最外层电子对。如 ![]() 中N原子最外层5个电子只有3个电子分别与H原子成键,剩下的2个电子叫做孤对电子。
中N原子最外层5个电子只有3个电子分别与H原子成键,剩下的2个电子叫做孤对电子。
![]() 分子中的N原子有孤对电子,所以
分子中的N原子有孤对电子,所以 ![]() 是极性分子。
是极性分子。
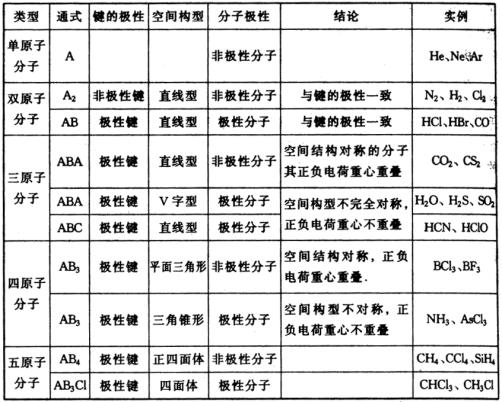
几种典型的分子构型
相似相溶原理
“凡是分子结构相似的物质,都是易于互相溶解的”。这是从大量事实总结出来的一条规律,叫做相似相溶原理。由于分子的极性是否相似对溶解性影响很大,所以相似相溶原理又可以理解为“极性分子易溶于极性溶剂中,非极性分子易溶于非极性溶剂中”。例如是 ![]() 非极性分子,作为溶剂它就是非极性溶剂;而
非极性分子,作为溶剂它就是非极性溶剂;而 ![]() 是极性分子,所以它是极性溶剂。
是极性分子,所以它是极性溶剂。 ![]() 等都是非极性分子,所以易溶于
等都是非极性分子,所以易溶于 ![]() 、苯等非极性溶剂,而在水这一极性溶剂中溶解度就很小。相反,盐类(
、苯等非极性溶剂,而在水这一极性溶剂中溶解度就很小。相反,盐类( ![]() 等)这些离子化合物可看作是极性最强的,它们就易溶于水而不溶于
等)这些离子化合物可看作是极性最强的,它们就易溶于水而不溶于 ![]() 、苯等非极性溶剂。
、苯等非极性溶剂。 ![]() 是强极性分子,易溶于水而难溶于
是强极性分子,易溶于水而难溶于 ![]() 。
。
利用相似相溶原理,有助于我们判断物质在不同溶剂中的溶解性。