 设为首页
设为首页
 加入收藏
加入收藏
教材分析
本节教材以原子结构、元素周期律的理论为指导,介绍碳族元素及其化合物的知识。教材从学生学过的碳元素入手,引出碳族元素,根据碳族元素在周期表中的位置和结构特点,研究、讨论碳族元素性质递变规律和共性,并以列表的形式简单介绍碳族元素的一些重要性质。在碳族元素中,碳及其化合物的知识已在初中介绍过,所以,本节主要介绍碳族元素中的另一种重要的代表元素—硅。教材从已学过的碳和元素周期律的知识入手,着重介绍了硅和二氧化硅的存在、性质、用途。例如,硅作为重要的半导体材料,在电子工业中有广泛的用途;二氧化硅既具有酸性氧化物的共性,又有其特性等。了解这些元素化合物知识,对于扩大学生对非金属和酸性氧化物的认识很有帮助。
旧教材中硅一章作为化学第二册中的第一章。其中碳族元素和硅及其重要的化合物分别为第一、二节。新教材中把二者合二为一,降低了难度,增加了知识的广度。
学生在学习氧族元素的知识之后,对元素周期律和原子结构理论的运用已经有了一些了解,碳族元素放在后面,就可以对所学知识有更进一步的认识。尤其是碳族元素从非金属性向金属性变化的规律很典型,对复习、巩固元素周期律和原子结构理论有重要作用。
为了不使学生感到枯燥,编写时注意联系生产和生活实际。例如,在介绍二氧化硅时,联系生活中常见的石英电子表、石英钟,以及自然界存在的水晶等,并配有插图。为了扩大学生的知识面,激发学生学习化学的兴趣,本书还安排了一段选学内容和一段阅读材料,供教师在教学中选用或供有兴趣的学生课外阅读。
在本节教材中,适当地编入了一些“讨论”。例如,在介绍碳族元素知识以前,安排了一个讨论,让学生先根据元素周期律的知识试着推断碳族元素性质变化的一些规律,然后再进行简单的归纳。这样,既复习、巩固了所学知识,也加深了对新学知识的理解。同时,还能启发学生思考,培养学生的能力。
本节教学重点:碳族元素性质递变规律,硅和二氧化硅的化学性质。
碳族元素性质递变的教学建议
1.掌握ⅣA族含碳(C)、硅(Si)、锗(Ge)、锡(Sn)、铅(Pb)5种元素。
2.应用原子结构和元素周期律的理论掌握:
(1)本族元素位于周期表里易失电子和易得电子主族元素的中间位置,原子最外层有4个电子,易生成共价化合物(主要指C、Si等)。
(2)各元素最高正价为+4价。
(3)随电子层数递增,元素的非金属性渐弱、金属性渐强。C、Si为非金属元素,C比Si非金属性强;Ge、Sn、Pb为金属元素,金属性依次增强(注意,Sn比Pb活泼仅适用于水溶液中的反应)。
3.从氧化还原角度分析,碳、硅、锗、锡的+4价化合物稳定,铅的+2价化合物稳定。
4.根据晶体类型和结构掌握,碳和硅的单质熔沸点高于另3种金属单质,且碳比硅高,锗、锡、铅的单质熔沸点依次降低(反常现象为锡比铅的熔点低)。
(备注:*部分不作要求,教师可以根据本地的具体情况灵活掌握。)
碳族元素的结构和性质比较
下面就碳族元素结构和性质进行了列表对比,教师在授课中可以参考使用。
|
碳
|
硅
|
锗
|
||||||||||
|
原子 结构 示意 图 |
|
|
|
|||||||||
|
锡
|
铅
|
|||||||||||
|
|
|
|||||||||||
|
原子半径 |
|
|||||||||||
|
元素的非金属性和金属性 |
|
|||||||||||
|
主要化合价 |
+4、+2 |
+4、+2 |
+4、+2 |
+4、+2 |
+2、+4 |
|||||||
|
单 质 |
色态 |
金刚石: 无色固体 石墨: 灰黑固体 |
晶体硅: 灰黑色 固体 |
银白色固体 |
银白色固体 |
蓝白色固体 |
||||||
|
密度 |
|
|||||||||||
|
熔、沸点 |
|
|||||||||||
|
氢化物 稳定性 |
|
|||||||||||
|
最高价氧化物对应的水化物酸性 |
|
|||||||||||
二氧化碳和二氧化硅的比较
建议教师可以在教学中将二氧化碳和二氧化硅进行对比,特别是二者在物理性质上的差异及其原因。
|
|
|
|
|
化学式 的意义 |
|
|
|
物理 性质 |
熔、沸点低,硬度小 |
熔沸点较高,硬度较大 |
|
化学 性质 |
①酸酐,具有酸性氧化物的通性 ②氧化性 ③与盐的反应 |
①酸酐,但不与水反应 ② ③ |
|
相应酸 的特点 |
|
|
质碳和硅的比较
建议教师在授课中运用比较法,把碳和硅从原子半径、成键特征、化学性质、用途等方面进行比较,这样有利于学生把前后知识联系起来。具体内容请参考下面的小结:
原子结构示意图
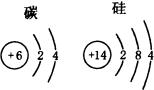
|
碳 |
硅 |
|
|
原子半径 |
相对较小 |
相对较大 |
|
成键特征 |
难以得失电子,主要靠共价键与其它原子结合 |
晶体硅的结构与金刚石结构相似,是具有正四面体型结构的原子晶体. |
|
化学性质 |
①在高温和点燃下有强还原性 ②不与碱反应 ③不与 |
①加热时可与 ②常温下和强碱溶液反应 ③常温下和 |
|
用途 |
做还原剂、吸附剂 |
做半导体材料 |
单晶硅、二氧化硅的性质和结构
本节主要介绍碳族元素中的另一种重要的代表元素:硅。下面将主要内容作一小结,供教师教课时参考。
像碳一样硅原子最外层有四个电子,但是由于硅原子比碳原子多一个电子层,半径比较大。硅元素的非金属性比碳元素弱。常温下,硅的化学性质比较稳定,但能与氟气、氢氟酸反应。
![]()
![]()
在一定条件下能够与氢氧化钠、氯气、氧气反应。
![]()
![]()
![]()
![]()
![]()
![]()
![]()
有趣的是,尽管单质硅的性质比较稳定,但是自然界中的硅元素并不以游离态的硅存在,只以化合态存在。因此,科学家认为在地球形成时代温度很高,硅与其他元素形成化合物,这些化合物又十分稳定。所以硅在自然界中以化合态存在。
单晶硅与金刚石一样具有正四面体型的立体空间网状结构,每个硅原子以四个共价键与其他四个硅原子相连,硅硅键之间的夹角为109°28′。每6个硅原子形成一个闭合的六元环。
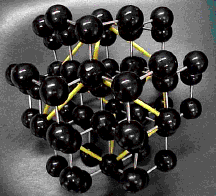
硅的结构
二氧化硅也是原子晶体,其结构可以看作是单晶硅中每个硅硅键的硅原子之间插入了一个氧原子。
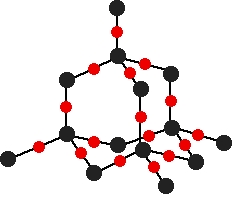
二氧化硅的结构( ![]() 代表硅原子;
代表硅原子; ![]() 代表氧原子)
代表氧原子)