 设为首页
设为首页
 加入收藏
加入收藏
例1 下列反应一定属于氧化还原反应的是( )
A.化合反应 B.置换反应
C.分解反应 D.复分解反应
解析:氧化还原反应的判断方法:
①有化合价升降的反应都是氧化还原反应;
②有单质参加或生成的反应都是氧化还原反应;
③复分解反应都不是氧化还原反应。
由上述可知,化合反应和分解反应可能是氧化还原反应,也可能不是氧化还原反应。如:
a.是氧化还原反应的: ![]()
![]()
![]()
![]()
b.是非氧化还原反应的:
![]()
![]()
![]()
![]()
置换反应一定是氧化还原反应,答案B。
例2 下面有关氧化还原的叙述,正确的是( )
A.非金属单质在反应中只作为氧化剂
B.金属单质在反应中只作为还原剂
C.金属原子失电子越多其还原性越强
D. ![]() 比
比 ![]() 氧化性强,
氧化性强, ![]() 比
比 ![]() 还原性强。
还原性强。
解析:失电子的作用叫氧化,价态升高。得电子的作用叫还原,价态降低。这种广义的氧化、还原概念比初中从得失氧的角度所建立的概念更科学。氧化剂具有氧化性,得电子能力越强,其氧化性越强,不能认为得电子数多,氧化性强。还原剂具有还原性,失电子能力越强,其还原性越强,也不是指失电子的数目。(C)不正确。
元素的价态与氧化性、还原性相关。一般处于最高价态的元素,如 ![]() 、
、 ![]() 、
、 ![]() 、
、 ![]() 等不能再失电子,只可能得电子而只有氧化性;处于最低价态的元素,如金属单质(0价)、
等不能再失电子,只可能得电子而只有氧化性;处于最低价态的元素,如金属单质(0价)、 ![]() 、
、 ![]() 、
、 ![]() 等不能再得电子,只有还原性;处于中间价态的元素,如
等不能再得电子,只有还原性;处于中间价态的元素,如 ![]() 、
、 ![]() 、
、 ![]() 既有氧化性又有还原性。(A)不正确,因为0价非金属处于中间价态。(B)正确
既有氧化性又有还原性。(A)不正确,因为0价非金属处于中间价态。(B)正确
金属的阳离子一般是氧化性越强,对应的金属单质还原性和金属活动性越弱。非金属的阴离子一般还原性越强,其对应的非金属单质的氧化性越弱。(D)正确。
答案:B、D
例3 下列反应中:① ![]()
![]()
![]()
② ![]()
![]()
![]()
③ ![]()
![]()
![]()
④ ![]()
![]()
![]()
⑤ ![]()
![]()
![]()
⑥ ![]()
![]()
![]()
(1)属于同种元素间氧化还原的是 ;
(2)属于一种元素还原两种元素 。
解析:标出各反应中元素价态的变化,找出电子得失,然后判断氧化还原关系可解。反应①是 ![]() 与
与 ![]() 间的氧化还原;反应②是
间的氧化还原;反应②是 ![]() 与
与 ![]() 之间的氧化还原,属于同种元素间的氧化还原反应;反应③是三种元素之间的氧化还原,电子转移方向和数目是:
之间的氧化还原,属于同种元素间的氧化还原反应;反应③是三种元素之间的氧化还原,电子转移方向和数目是:
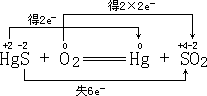
![]() 失电子把
失电子把 ![]() 还原为
还原为 ![]() ,将
,将 ![]() 还原为
还原为 ![]() ,属于一种元素还原两种元素;反应④是
,属于一种元素还原两种元素;反应④是 ![]() 被还原为
被还原为 ![]() 和
和 ![]() ;反应⑤是
;反应⑤是 ![]() 中的
中的 ![]() 把
把 ![]() 氧化成
氧化成 ![]() 的反应;反应⑥是
的反应;反应⑥是 ![]() 的自身氧化还原:
的自身氧化还原:
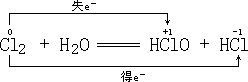
氯气分子中1个 ![]() 原子失去一个电子转化为
原子失去一个电子转化为 ![]() 中的
中的 ![]() ,另1个原子得到此电子转化成
,另1个原子得到此电子转化成 ![]() 中的
中的 ![]() ,也是同种元素间的氧化还原反应。
,也是同种元素间的氧化还原反应。
答案:(1)②⑥ (2)③
例4 下列反应中,哪些元素被氧化?哪些元素被还原?用双桥标出电子得失数目,指出氧化剂、还原剂。
(1) ![]()
(2) ![]()
(3) ![]()
解析:(1)首先标出化合价发生变化元素的化合价:
![]()
![]() 化合价升高,失电子,被氧化
化合价升高,失电子,被氧化
![]() 化合价降低,得电子,被还原
化合价降低,得电子,被还原
![]() 化合价降低,得电子,被还原
化合价降低,得电子,被还原
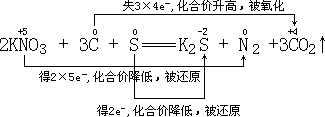
还原剂C,氧化剂 ![]() 、S。
、S。
(2)首先标出化合价发生变化元素的化合价:
![]()
![]() 化合价升高,失电子,被氧化
化合价升高,失电子,被氧化
![]() 化合价降低,得电子,被还原。
化合价降低,得电子,被还原。
![]() 既是氧化剂又是还原剂。
既是氧化剂又是还原剂。
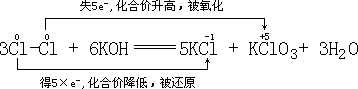
(3)首先标出化合价发生变化元素的化合价:
![]()
![]() 化合价升高,失电子,被氧化
化合价升高,失电子,被氧化
![]() 化合价降低,得电子,被还原
化合价降低,得电子,被还原
易出现的错误: ![]() 化合价升高,失电子,被氧化
化合价升高,失电子,被氧化
![]() 化合价降低,得电子,被还原
化合价降低,得电子,被还原
错误原因是:同一元素的不同价态间发生氧化还原反应,其生成物价态只能处于该元素高、低价态之间。应为

氧化剂: ![]() 还原剂:
还原剂: ![]()
例5 根据下列反应判断有关物质还原性由强到弱的顺序是( )
① ![]()
② ![]()
③ ![]()
A. ![]() B.
B. ![]()
C. ![]() D.
D. ![]()
解析:此题是根据物质氧化性或还原性强弱的规律解题。此内容出现在新高二教材第三章中。但是有学习基础的学校,可在介绍过氧化产物、还原产物后适当延伸至此。
氧化剂本身被还原,其生成物为还原产物,还原剂本身被氧化,其生成物为氧化产物。在同一氧化还原反应中,氧化剂+还原剂=还原产物+氧化产物,还原性:还原剂>还原产物;氧化性:氧化剂>氧化产物,概括为:左>右。
根据此规律:由反应式①可知还原性 ![]() ,由②可知还原性
,由②可知还原性 ![]() ,由③可知还原性
,由③可知还原性 ![]() 。综合①②③得;还原性由强到弱:
。综合①②③得;还原性由强到弱: ![]() 。
。
答案:A。