 设为首页
设为首页
 加入收藏
加入收藏
例1 设NA代表阿伏加德罗常数,下列说法正确的是( )
(A)2.3g金属钠全部变成钠离子时失去的电子数目为0.2NA
(B)2g氢气所含原子数目为NA
(C)17gNH3 所含的电子数为10NA
(D)NA个氧分子和NA个氢分子的质量比等于16 :1
选题目的:这是一道应用物质的量的概念来解的典型例题。考察学生对物质的量及其单位的理解,以及物质的量与阿伏加德罗常数的关系。
分析: A中2.3g钠的物质的量为0.1mol,每摩钠变成钠离子时失去1mol电子,所以2.3g钠应失去0.1mol电子,即失去电子数为0.1NA,A不正确。 B中氢气是由氢分子组成的物质,氢分子是双原子分子,其相对分子质量为2,所以2g氢气所含的氢分子数目为NA,氢原子数目应为2NA,B不正确。C中NH3是含10个电子的分子,其相对分子质量为17,所以17gNH3的物质的量为1mol,所含电子的物质的量为10mol,电子数目为10NA,C正确。D 中由于NA个氧分子的质量在数值上等于它的摩尔质量,NA个氢分子的质量在数值上等于它的摩尔质量,所以二者的质量比为32 :2=16 :1,D正确。
解答:C、D
启示:物质的量、粒子数及质量的关系应用极其广泛,必须认真学好。
例2:判断下列说法是否正确,说明理由。
(1)1molO2的质量是32g/mol
(2)H2的摩尔质量是2g
(3)1molH+的质量是1g
(4)对原子而言,摩尔质量就是原子量
(5)每摩任何物质都含有6.02×1023个微粒
选题目的:这是一道巩固摩尔质量概念的判断题。
分析:质量的单位是“g”等,摩尔质量的单位是“g/mol”,所以(1)、(2)都是错误的,(3)正确(此时忽略了失去的电子的质量)。对于原子而言,1mol某原子的质量数值上等于该原子的原子量,而单位不同,因此(4)是错误的。当使用物质的量时,必须指出微粒的名称,例如:1molMgCl2中含有1molNa+,2molCl-,所以在(5)中笼统的说“每摩物质”是不正确的。
解答:(1)错误(2)错误(3)正确(4)错误(5)错误
启示:摩尔概念与相对分子质量、相对原子质量是不同的两个概念,二者只是数值上相等。
例3:设一个12C原子的质量为ag,一个R原子的质量为bg,阿伏加德罗常数为NA,则R的相对原子质量可以表示为 ( )
(A)
![]() (B)
(B)
![]() (C)bNA
(D)aNA
(C)bNA
(D)aNA
选题目的:此题是考查学生对原子的质量、相对原子质量、摩尔质量三个概念的理解,具有综合性,容易暴露出问题。
分析:某原子的相对质量是以一个12C原子质量的 ![]() 作为标准,该原子的绝对质量与其相比所得的比值。因此得出R原子的相对原子质量=
作为标准,该原子的绝对质量与其相比所得的比值。因此得出R原子的相对原子质量= 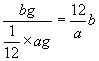 。B选项是正确的。还可以从另一个角度考虑。相对原子质量与摩尔质量在数值上是相等的。因此可以求出1molR原子的质量。因为1molR原子有阿伏加德罗常数个原子,而已知一个R原子的质量为bg,所以1molR原子的质量为bNA克。R原子的相对原子质量可以表示为 bNA。
。B选项是正确的。还可以从另一个角度考虑。相对原子质量与摩尔质量在数值上是相等的。因此可以求出1molR原子的质量。因为1molR原子有阿伏加德罗常数个原子,而已知一个R原子的质量为bg,所以1molR原子的质量为bNA克。R原子的相对原子质量可以表示为 bNA。
解答:B、C
启示:运用对比的方法学习概念是行之有效的。
例4:下列叙述正确的是
A.同质量的H2与Cl2相比,H2的分子数多
B.28g氮气所含的原子数目为NA
C.0.1mol H2SO4含有氢原子数精确值为1.204×1023
D.醋酸的摩尔质量与NA个醋酸分子的质量在数值上相等
选题目的:a.以题带类,归纳解题思路——物质的量与摩尔质量成反比;b.学会阅读,找出关键字词——精确值与近似值
思路分析:A中由分子构成的物质,当物质的量相同时含有相同的分子数,物质的量越大含有的分子数越多;同质量的H2和Cl2,H2的物质的量为a/2mol;Cl2的物质的量为a/71 mol,可见H2的分子数多;B中28g氮气为1mol,含有的氮原子数为2NA;阿伏加德罗常数的精确值是0.012kg12C所含有的碳原子数,它的实验测定值为6.02×1023,属于近似值,C不正确;D中醋酸的摩尔质量即NA个醋酸分子的质量。
解答:A、D
启示:把握基本类型,总结规律性。