 设为首页
设为首页
 加入收藏
加入收藏
例1 设NA为阿伏加德罗常数的值,下列关于0.2mol/L的CaCl2溶液不正确的说法是
A.2L溶液中阴阳离子总数为0.8NA
B.500mL溶液中Cl-离子浓度为0.2mol/L
C.500mL溶液中Ca2+离子浓度为0.2mol/L
D.500mL溶液中Cl-离子总数为0.2NA
选题目的:a.复习电解质电离的概念。B.把物质的量、物质的量浓度的概念和溶液中溶质的粒子数、溶液的体积相结合,加深对有关概念的理解。适合中下等学生。
思路分析 :根据 CaCl2 = Ca2+ + 2Cl- 溶液中Ca2+和Cl-的浓度与体积无关;溶质的物质的量与溶液体积有关。A项离子总数应为(0.2+0.4)×2=1.2(NA)B项Cl-离子浓度应为2×0.2mol/L=0.4mol/L C、D项正确。
解答:A、B
启示:认真审题,理解概念轻松解题。
例2 标准状况下350体积的氨气溶解在1体积的水中,求这种氨水的物质的量浓度。(氨水密度为0.924g/cm3)
选题目的:考查本章各知识点的综合,包括物质的量、气体摩尔体积和物质的量浓度。这是一道对以上概念理解和应用的基础题,熟练掌握有关计算是十分必要的。
思路分析 :分别求出n(NH3)和V(氨水)
解答:n(NH3)=
![]()
V(氨水)=
![]()
=1.369L
C(氨水)=
![]()
启示:以概念为基础,确定计算题的解题思路。
例3 把100mL98%的浓H2SO4(
![]() =1.84g/cm3)与400mL的水混合成密度为1.225g/cm3的稀H2SO4的质量分数和物质的量浓度。
=1.84g/cm3)与400mL的水混合成密度为1.225g/cm3的稀H2SO4的质量分数和物质的量浓度。
选题目的:a.本题涉及到物质的量浓度,浓溶液的稀释,溶液质量分数,是物质的量浓度计算的常见题型。b.同溶质的不同浓度的溶液密度不同,如何计算混合溶液的体积。
思路分析 :注意:(1)溶液稀释前后,溶质的质量不改变,即溶质的物质的量不变。(2)两种同溶质的溶液(或一方为水)相混合时,总体积是否改变,决定于溶液密度是否改变。若密度不变,则V(混)=V1+V2,若密度改变,则V(混)
![]() V1+V2应为
V(混)=
V1+V2应为
V(混)= ![]()
解答:1.求稀H2SO4的质量分数
纯H2SO4质量100mL×1.84g/cm3×98%=180.32g
稀H2SO4的质量100mL×1.84g/+400mL×1g/ cm3=584g
H2SO4%=
![]() %=30.88%
%=30.88%
2.求稀H2SO4的物质的量浓度
c(H2SO4)=
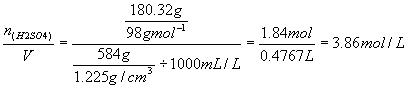
启示:已知条件较多时,正确的思路尤其重要。
例4 利用碳酸钠晶体(Na2CO3·10H2O)来配制0.5mol/L的Na2CO3溶液1000mL,假如其他操作均准确无误,下列情况会引起配制溶液的浓度偏高的是( )偏低的是( )
A.称取碳酸钠晶体100g
B.定容时,俯视观察刻度线
C.移液时,对用于溶解碳酸钠晶体的烧杯没有进行冲洗
D.定容后,将容量瓶振荡均匀,静置时发现液面低于刻度线,于是又加入少量水至刻度线
选题目的:本题是针对配制一定物质的量浓度溶液,所设计到的实验过程,有关计算和易出现的误差的习题,着重在理解概念的基础上掌握实验技能技巧。
思路分析 :A项极易出错,以0.5mol/L×1L=0.5mol 是Na2CO3的物质的量,得出质量是53g,所以100g>53g视为偏高。实际上应是Na2CO3·10H2O的质量0.5mol×286g/mol=143g。所以A项应偏低。B项俯视时液面的最低点低于刻度线,即实际加水量少于应加水量,因此可导致浓度偏高。C项对用于稀释或溶解的烧杯,如不加水洗涤数次并将洗涤液转入容量瓶,会使溶质损失,使所配溶液浓度偏低。D项定容后,当振荡、静置后发现液面低于刻度线,这是由于液体沾在瓶壁和磨口处所致,不会造成偏差,若加水使所配溶液浓度偏低。
解答:B; A、C、D.
启示:不但要掌握正确的实验过程,还要清楚这样做的原因。