 设为首页
设为首页
 加入收藏
加入收藏
例1 下列有关物质的用途(括号中为用途)错误的是( )
(A)锗和硅(半导体材料)
(B)二氧化硅(制光导纤维)
(C)水玻璃(用作粘合剂)
(D)原硅酸(用作耐火材料)
选题目的:考查物质的用途要结合物质的性质。
解析:锗和硅的导电性介于导体和绝缘体之间,属于半导体,可作为半导体材料。纯净的二氧化硅晶体具有良好的折光性能,可用于制作光导纤维。水玻璃是Na2SiO3的水溶液,无色、粘稠、粘结性强,既不易燃烧又不易受腐蚀,可用作建筑工业粘合剂,木材、织物的防腐剂、防火剂。原硅酸是一种不溶于水的弱酸,不稳定,在空气中失去一部分水后变成硅酸,因此不能用作耐火材料。
答案:D
例2 下列有关碳族元素的叙述中,不正确的是( )
A.碳族元素易形成共价化合物
B.碳族元素最高价氧化物均易溶于水
C.碳族元素中硅和锗可作半导体材料
D.碳族元素的非金属性向金属性递变的趋势没有氮族元素明显
解析:此题主要考查碳族元素的单质及化合物性质及其递变规律,碳族元素位于周期表中容易失去电子的主族元素和容易得到电子的主族元素中间位置,容易形成共价化合物,最高价氧化物并不是易溶于水的化合物,如![]() 就不溶。硅和锗在周期表的特殊位置,使其导电性介于导体和绝缘体之间,是重要的半导体材料。碳族元素的非金属性向金属性递变的趋势比氮族元素更明显。
就不溶。硅和锗在周期表的特殊位置,使其导电性介于导体和绝缘体之间,是重要的半导体材料。碳族元素的非金属性向金属性递变的趋势比氮族元素更明显。
答案:B、D。
启示:碳族元素性质的递变性和前面学过的典型的金属元素碱金属、典型的非金属元素卤族元素联系起来。
碳族元素、碱金属和卤族元素的熔点、沸点怎样变化?
答案:随着核电荷数的增加,熔点、沸点逐渐降低。
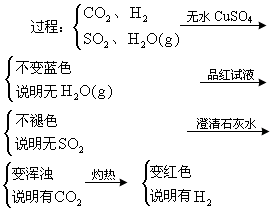
例3 某无色混合气体中可能含有![]() 及水蒸气中的两种或多种,当混合气体依次通过:(1)澄清石灰水(无浑浊现象);(2)氢氧化钡(有浑浊现象);(3)浓硫酸(无现象);(4)灼热氧化铜(变红色);(5)无水硫酸铜(变蓝色)。试分析该混合气体中肯定有什么,肯定没有什么,可能有什么。
及水蒸气中的两种或多种,当混合气体依次通过:(1)澄清石灰水(无浑浊现象);(2)氢氧化钡(有浑浊现象);(3)浓硫酸(无现象);(4)灼热氧化铜(变红色);(5)无水硫酸铜(变蓝色)。试分析该混合气体中肯定有什么,肯定没有什么,可能有什么。
解析:此题是一道由化学实验现象推断混合气体成分的应用题,要求有扎实的元素及其化合物知识,以及较强的逻辑分析推理能力。正确解答本题,可通过下列程序分析推理:
(1)氢氧化钡溶液有浑浊现象,说明混合气体中一定含有![]() 。(2)澄清石灰水无浑浊现象,说明混合气体中一定含有气体
。(2)澄清石灰水无浑浊现象,说明混合气体中一定含有气体![]() ,否则观察不到题中(1)的现象,而且气体的量至少应将
,否则观察不到题中(1)的现象,而且气体的量至少应将![]() 完全中和,又因
完全中和,又因![]() 和
和![]() 不能共存,所以
不能共存,所以![]() 肯定不存在。(3)浓硫酸起到干燥作用。(4)无水硫酸铜变蓝色,说明题中(4)反应中肯定产生了
肯定不存在。(3)浓硫酸起到干燥作用。(4)无水硫酸铜变蓝色,说明题中(4)反应中肯定产生了![]() ,进一步推出混合气体中肯定含有
,进一步推出混合气体中肯定含有![]() 。CO是否存在无法判断;原混合气体是否有水蒸气无法判断。
。CO是否存在无法判断;原混合气体是否有水蒸气无法判断。
答案:混合气体中肯定有![]() 、
、![]() 和
和![]() ;肯定没有
;肯定没有![]() ;可能有CO、水蒸气。
;可能有CO、水蒸气。
强化训练:某无色混合气体,可能含有![]() 、
、![]() 、
、![]() 、水蒸气中的一种或几种。将混合气体依次通过无水硫酸铜、少量品红试液、澄清石灰水、灼热
、水蒸气中的一种或几种。将混合气体依次通过无水硫酸铜、少量品红试液、澄清石灰水、灼热![]() 时观察到的现象为:无水硫酸铜不变色,品红试液不褪色,澄清石灰水变浑浊,灼热的
时观察到的现象为:无水硫酸铜不变色,品红试液不褪色,澄清石灰水变浑浊,灼热的![]() 变红色。根据以上实验现象可断定,该混合气体是由
组成。
变红色。根据以上实验现象可断定,该混合气体是由
组成。
所以,原混合气体是由![]() 和
和![]() 组成。
组成。
例4 ![]() 按照氧化物的形式可表示为
按照氧化物的形式可表示为![]() ,若将其看做一种盐可表示为
,若将其看做一种盐可表示为![]() 。(1)试根据化合价规则对
。(1)试根据化合价规则对![]() 用上述两种形式表示组成,其氧化物形式应为
,其盐的形式应为
。
用上述两种形式表示组成,其氧化物形式应为
,其盐的形式应为
。
(2)已知铅的+2价化合物是稳定的,则铅的+4价化合物应具有较强的氧化性。![]() 与浓盐酸可发生氧化还原反应生成
与浓盐酸可发生氧化还原反应生成![]() 。试写出
。试写出![]() 与浓盐酸发生反应的化学方程式。
与浓盐酸发生反应的化学方程式。
解析:这是一道信息迁移题。题中铅元素的化合价与铁元素不同,呈+2价和+4价,所以氧化物形式写成![]() ,盐的形式写成
,盐的形式写成![]() 。
。![]() ,与盐酸的反应可理解为
,与盐酸的反应可理解为
![]() 和
和![]() 。
。
答案:(1)![]() ;
;![]()
(2)![]()
强化训练:有一种锰和氧的化合物可以称为高锰酸锰,其中锰元素呈+2价和+7价两种价态,则这种化合物的化学式为 。
答案:![]() 或
或![]() 。
。
例5 将过量的![]() 分别通入①
分别通入①![]() 溶液 ②
溶液 ②![]() 溶液 ③
溶液 ③![]() 溶液 ④饱和的
溶液 ④饱和的![]() 溶液,最终溶液中有白色沉淀析出的是(
)
溶液,最终溶液中有白色沉淀析出的是(
)
A.①②③④ B.②④ C.①②③ D.②③④
选题目的:![]() 对应的酸为碳酸,碳酸是一种不稳定易分解的二元弱酸,本题实质是考查对碳酸性质的理解。
对应的酸为碳酸,碳酸是一种不稳定易分解的二元弱酸,本题实质是考查对碳酸性质的理解。
解析:![]() 只能与比碳酸更弱的酸的盐反应,生成新酸和新盐,而不能与酸性较碳酸强的酸的盐反应,所以,
只能与比碳酸更弱的酸的盐反应,生成新酸和新盐,而不能与酸性较碳酸强的酸的盐反应,所以,![]() 通入
通入![]() 溶液中无反应发生,无沉淀生成,
溶液中无反应发生,无沉淀生成,![]() 通入
通入![]() 溶液中有如下反应:
溶液中有如下反应:
![]()
生成![]() 沉淀,在通入
沉淀,在通入![]() 过量的情况下,沉淀不会溶解。
过量的情况下,沉淀不会溶解。
当![]() 通入
通入![]() 溶液中,将发生如下反应:
溶液中,将发生如下反应:
![]()
但在通入过量![]() 时,
时,![]() 转为
转为![]() ,沉淀将溶解
,沉淀将溶解
![]()
所以当过量![]() 通入
通入![]() 溶液中,最终无沉淀生成。
溶液中,最终无沉淀生成。
若![]() 通入饱和
通入饱和![]() 溶液,
溶液,![]() 将转为
将转为![]() ,
,
![]()
![]() 和
和![]() 同属于可溶性的盐,但在同温度时,
同属于可溶性的盐,但在同温度时,![]() 的溶解度大于
的溶解度大于![]() 的溶解度,而由
的溶解度,而由![]() 转化生成的
转化生成的![]() 的质量大于原有
的质量大于原有![]() 的质量,且在转化过程中还要消耗溶剂水,故将有
的质量,且在转化过程中还要消耗溶剂水,故将有![]() 沉淀析出。通入过量的
沉淀析出。通入过量的![]() 对沉淀无影响,故本题答案为②④。
对沉淀无影响,故本题答案为②④。
答案:B
启示:在复分解反应中,酸可以和盐反应生成新的酸和新的盐。一般有两种情况,一是较强的酸制较弱的酸,二是高沸点酸制低沸点酸,其中有个别例外情况,如:
![]()
在![]() 溶液中通入
溶液中通入![]() ,有黑色
,有黑色![]() 沉淀生成,溶液中则形成硫酸,这是由于
沉淀生成,溶液中则形成硫酸,这是由于![]() 不溶于水,也不溶于一般酸,所以能发生上述反应。这种情况是很少的。
不溶于水,也不溶于一般酸,所以能发生上述反应。这种情况是很少的。
本题还涉及到![]() 的溶解度的问题,酸式盐的溶解度一般大于相应的正盐的溶解度,但是
的溶解度的问题,酸式盐的溶解度一般大于相应的正盐的溶解度,但是![]() 的溶解度比
的溶解度比![]() 大,这是例外情况,但不能由此认为
大,这是例外情况,但不能由此认为![]() 是一种难溶于水的物质,20℃时,
是一种难溶于水的物质,20℃时,![]() 溶解度为9.6g,是一种可溶物质。
溶解度为9.6g,是一种可溶物质。
例6 根据金刚石=石墨+1.89kJ,可以得出的结论是( )
A.石墨比金刚石稳定 B.石墨和金刚石互为同素异形体
C.金刚石转变为石墨时能量升高 D.属于物理变化
解析:由于各种物质所具有的能量不同,如果反应物的总能量高于生成物所具有的总能量,那么在发生化学反应时,有一部分能量就会转变成热量等形式释放出来,这就是放热反应,如果反应物所具有的总能量低于生成物所具有的总能量,那么在发生化学反应时,反应物就需要吸收能量才能转化为生成物,这就是吸热反应。
所以上式说明金刚石所具有总能量高于石墨所具有的能量,由金刚石转变为石墨时,将有能量向外释放,物质所具有能量较低,则较为稳定,若使其发生化学变化,需要提供更多的能量。由上述转化关系也可说明石墨较金刚石稳定,金刚石转变为石墨时能量降低。
上述转化过程没有其他物质参加,仅是由碳元素组成的单质的转化,能量的变化表现出两物质结构的差异,因此金刚石与石墨应为同由碳元素形成的结构性质不同的单质,也就是互为同素异形体,所以,上述变化的实质是由一种物质转变为一种新的物质,是一种化学变化。
答案:A、B
启示:元素形成同素异形体的现象较多,如碳元素的同素体有金刚石、石墨、![]() 、
、![]() 等。氧元素的同素异形体有
等。氧元素的同素异形体有![]() 和
和![]() (臭氧)。磷元素的同素异形体有白磷和红磷等。同一元素形成的同素异形体是不同的物质,因此在一定条件下的同素异形体的转化属于化学变化。
(臭氧)。磷元素的同素异形体有白磷和红磷等。同一元素形成的同素异形体是不同的物质,因此在一定条件下的同素异形体的转化属于化学变化。
如:金刚石=石墨
![]()
在这种转化中无化合价的变化(单质中元素的化合价均视为0价),因此不属于氧化还原反应,同时也不属于四类基本反应(化合、分解、置换、复分解)中的任何一类。
例7 草酸晶体与浓硫酸共热可制得CO,其化学方程式如下:
![]() ,现利用该反应制取CO气体,要求:a.验证CO还原性及其氧化产物。b.剩余气体CO不能排入大气中,并回答有关问题:
,现利用该反应制取CO气体,要求:a.验证CO还原性及其氧化产物。b.剩余气体CO不能排入大气中,并回答有关问题:
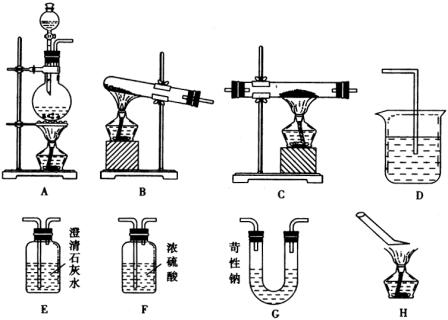
(1)试从图中选用几种装置(有些可重复使用)连接成一套实验装置,所选用的装置及连接顺序为 。
(2)用简洁的文字说明所选的装置,如何达到上述两要求:a. ;b. 。
93)在装置C中的化学反应方程式为 。
(4)本实验有四个酒精灯A、B、C、H,正确操作时点燃酒精灯的顺序是 ;试简单说明理由; 。熄灭酒精灯的顺序是 ;试简单说明理由: 。
(5)用有效气体还原![]() 将生成的气体通入过量澄清石灰水中,生成0.75g白色沉淀,则
将生成的气体通入过量澄清石灰水中,生成0.75g白色沉淀,则![]() 中
中![]() 值是
,
值是
,![]() 值是
。
值是
。
选题目的:本题要根据反应原理,实验装置及提供的试剂,实验目的及实验过程进行综合分析,确定实验操作的具体步骤和仪器的连接顺序,根据题意,回答有关实验的一些具体问题。
解析:本实验的原理及步骤是,加热草酸晶体,使之分解,制取CO气体,并要求a.验证CO的还原性及其氧化产物,b.剩余气体CO不能排入大气中。
在制取气体时,根据方程式:
![]()
可知这是一个固体与液体物质在加热条件下制取气体的反应,应选装置A。
因为草酸在加热中分解生成CO时,同时有![]() 和
和![]() 生成,若不除去则影响CO还原性和进行氧化产物
生成,若不除去则影响CO还原性和进行氧化产物![]() 的鉴定。可选用装有苛性钠的U型管以吸收混合气体中的
的鉴定。可选用装有苛性钠的U型管以吸收混合气体中的![]() ,同时还要配以装有澄清石灰水的装置E。当气体通过G装置后进行装置E无浑浊出现,说明混合气体中
,同时还要配以装有澄清石灰水的装置E。当气体通过G装置后进行装置E无浑浊出现,说明混合气体中![]() 已除尽,然后通过装有浓
已除尽,然后通过装有浓![]() 的洗气瓶进行干燥,才能进入装置C与
的洗气瓶进行干燥,才能进入装置C与![]() 反应,证明CO的还原性。
反应,证明CO的还原性。
在C中反应生成Fe和![]() ,证明生成了
,证明生成了![]() ,只能再次选用装置E,其中溶液在气体通过后出现浑浊,证明在反应中已生成了
,只能再次选用装置E,其中溶液在气体通过后出现浑浊,证明在反应中已生成了![]() ,这就说明了CO的还原性,CO在反应中被氧化为
,这就说明了CO的还原性,CO在反应中被氧化为![]() ,剩余CO不能向空气中排放,无其他试剂可以将其吸收,所以将尾气在H处点燃,使未反应的CO转化为
,剩余CO不能向空气中排放,无其他试剂可以将其吸收,所以将尾气在H处点燃,使未反应的CO转化为![]() 。
。
实验中有三处装置使用酒精灯,即A、C、H。正确操作点燃酒精灯的顺序应为A→H→C。使分解产生的气体将系统内的空气排净,防止加热时发生爆炸,而熄灭酒精灯的顺序应为C→A→H。这是因为要使已被还原的铁粉在CO的气流中冷却,以防止再被氧化影响实验结果。
实验最后给出测定的有关数值,要求确定![]() 中的
中的![]() 和
和![]() 值:
值:
![]()
![]()
![]()
![]()
![]()
![]() 中含氧原子的物质的量:
中含氧原子的物质的量:
![]()
![]()
![]()
故![]()
答案:(1)A→G→E→F→C→E→H
(2)a.草酸分解气体通过装置E时无白色沉淀生成说明其中所含![]() 已除尽,通过装置C反应后气体通过第二个装置E时出现白色沉淀,说明CO的氧化产物为
已除尽,通过装置C反应后气体通过第二个装置E时出现白色沉淀,说明CO的氧化产物为![]() 。
。
b.尾气在装置H处点燃,使剩余的CO转化为![]()
(3)![]()
![]()
![]()
(4)A→H→C,使分解产生的气体把实验系统内的空气排尽,防止加热时引起爆炸
C→A→H,使热的铁粉在CO气流中冷却,防止铁粉再次被氧化
(5)2、3