 设为首页
设为首页
 加入收藏
加入收藏
扩展资料
怎样才能学好盐类的水解
1.从水的电离平衡移动入手,认识盐的水解实质
盐溶于水电离出来的某种离子,使水的电离平衡发生移动,是盐溶液呈现不同酸碱性的原因。
(1)弱碱强酸盐的水解
在 ![]() 溶液中,存在
溶液中,存在 ![]() 的电离和水的电离
的电离和水的电离
![]()
![]()
![]()
![]()
![]() 电离出来的
电离出来的 ![]() 可以跟水电离出来的
可以跟水电离出来的 ![]() 结合成弱电解质
结合成弱电解质 ![]() ,使
,使 ![]() 下降,水的电离平衡向正向移动,从而造成溶液中的
下降,水的电离平衡向正向移动,从而造成溶液中的 ![]() 溶液呈现酸性。水解过程可以表示如下:
溶液呈现酸性。水解过程可以表示如下:
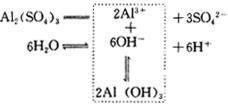
从 ![]() 水解的实例可以看出,弱碱强酸盐电离出的弱碱阳离子,跟
水解的实例可以看出,弱碱强酸盐电离出的弱碱阳离子,跟 ![]() 电离出来的
电离出来的 ![]() 结合为弱电解质分子,使水的电离平衡向正方向移动,
结合为弱电解质分子,使水的电离平衡向正方向移动, ![]() 不断增大,直至建立新的平衡,溶液呈现酸性。
不断增大,直至建立新的平衡,溶液呈现酸性。
(2)弱酸强碱盐的水解
在 ![]() 溶液中的弱酸根阴离子,
溶液中的弱酸根阴离子, ![]() 与
与 ![]() 电离出来的
电离出来的 ![]() 结合成弱电解质
结合成弱电解质 ![]() 分子,使
分子,使 ![]() 的电离平衡向正向移动,
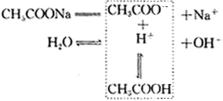
的电离平衡向正向移动, ![]() 不断增大,直至建立起新的平衡,溶液呈现碱性。
不断增大,直至建立起新的平衡,溶液呈现碱性。 ![]() 的水解过程可以表示如下:
的水解过程可以表示如下:
2.掌握盐的水解规律
盐的水解是由盐电离出来的弱离子的性质决定的,学习时要掌握各种不同盐类的水解规律。
(1)弱碱强酸盐
可溶性的弱碱强酸盐,如 ![]() 、
、 ![]() 、
、 ![]() 等能发生水解反应,水解后溶液呈现酸性。
等能发生水解反应,水解后溶液呈现酸性。
(2)弱酸强碱盐 可溶性的弱酸强碱盐,如 ![]() 、
、 ![]() 、
、 ![]() 、
、 ![]() 等能发生水解反应,水解后溶液呈现碱性。
等能发生水解反应,水解后溶液呈现碱性。
(3)弱酸弱碱盐
可溶性的弱酸弱碱盐,如 ![]() 、
、 ![]() 、
、 ![]() 等很容易发生水解反应,水解后溶液的酸碱性取决于该盐水解生成的弱酸、弱碱的相对强弱。
等很容易发生水解反应,水解后溶液的酸碱性取决于该盐水解生成的弱酸、弱碱的相对强弱。
(4)强酸强碱盐 各种强酸强碱盐均不能发生水解反应,溶液仍为中性。
为了便于记忆,可以把盐的水解规律简要概括如下:
谁弱谁水解,谁强显谁性;
两强不水解,溶液呈中性;
两弱易水解,酸碱相对性。
3.正确书写盐类水解的离子方程式
盐类水解属于离子反应,可以按照离子方程式的书写规范,写出正确的离子方程式。例如,硫酸铜水解的离子方程式可按以下三个步骤写出:
第一步 写出 ![]() 水解的化学方程式
水解的化学方程式
![]()
![]()
![]()
第二步 把易溶于水的强电解质改写为离子形式
![]()
![]()
![]()
第三步 消去反应式两边相同的离子( ![]() )
)
![]()
![]()
![]()
上述这个盐类水解的离子方程式揭示了 ![]() 水解的实质,是
水解的实质,是 ![]() 使水的电离平衡破坏,生成
使水的电离平衡破坏,生成 ![]() 弱碱分子和
弱碱分子和 ![]() ,使溶液呈现酸性,比盐类水解的化学方程式有更大的优越性。
,使溶液呈现酸性,比盐类水解的化学方程式有更大的优越性。
书写盐类水解的离子方程式时,要注意以下三点:
(1)要写可逆号“ ![]() ”,不能写等号。
”,不能写等号。
(2)难溶化合物不写沉淀符号“↓”。
(3)气体物质不写气体符号“↑”。
怎样才能又迅速、又准确地书写盐类水解的离子方程式呢?
(1)弱碱强酸盐水解的离子方程式是弱碱阳离子的水解,弱碱阳离子所带电荷数,就是水分子的系数,也是氢离子的系数。例如, ![]() 水解的离子方程式是:
水解的离子方程式是:
![]()
![]()
![]()
又如, ![]() 水解的离子方程式是:
水解的离子方程式是:
![]()
![]()
![]()
(2)弱酸强碱盐类水解的离子方程式是弱酸根离子与水分子反应,生成弱酸分子和氢氧根离子。一元弱酸根离子水解时,各微粒的系数都是“1”。例如, ![]() 水解的离子方程式是:
水解的离子方程式是:
![]()
![]()
![]()
多元弱酸根离子的水解是分步进行的,水解的离子方程式也要分步书写。例如,碳酸钠水解的离子方程式是:
![]()
![]()
![]() (一步水解)
(一步水解)
![]()
![]()
![]() (二步水解)
(二步水解)
又如,硫化钠水解的离子方程式是:
![]()
![]()
![]() (一步水解)
(一步水解)
![]()
![]()
![]() (二步水解)
(二步水解)
4.抓好盐类水解平衡的移动
盐类水解是个可逆反应,水解过程是个吸热反应,运用平衡移动原理,改变外界条件,便可以控制盐类水解的方向。
(1)升温促使盐类水解,降温抑制水解
用沸水(相当于加热至100℃)溶解 ![]() ,可以增强溶液的碱性
,可以增强溶液的碱性
![]()
![]()
![]()
在含有 ![]() 的溶液里,通入过热水蒸气,可以使
的溶液里,通入过热水蒸气,可以使 ![]() 以
以 ![]() 的形式沉淀出来,从而达到除去
的形式沉淀出来,从而达到除去 ![]() 的目的。
的目的。
![]()
(过热)
在配制 ![]() 、
、 ![]() 等重金属盐溶液时,为了防止
等重金属盐溶液时,为了防止 ![]() 、
、 ![]() 的水解,必须用冷水溶解,并不得加热。
的水解,必须用冷水溶解,并不得加热。
(2)降低pH抑制弱碱强酸盐的水解
弱碱强酸盐水解,溶液呈酸性,加入强酸,降低pH,可抑制这些盐的水解。例如,配制 ![]() 溶液时,要加入少量盐酸,防止
溶液时,要加入少量盐酸,防止 ![]() 的水解;又知,配制
的水解;又知,配制 ![]() 溶液时,要加入少量硫酸,抑制
溶液时,要加入少量硫酸,抑制 ![]() 的水解。
的水解。
(3)不断减少 ![]() ,使弱碱强酸盐水解得以完成
,使弱碱强酸盐水解得以完成
在 ![]() 溶液中加入
溶液中加入 ![]() 粉时,
粉时, ![]() 与
与 ![]() 水解出的
水解出的 ![]() 不断反应,使
不断反应,使 ![]() 的水解平衡不断向右移动,生成
的水解平衡不断向右移动,生成 ![]() 沉淀
沉淀
![]()
![]()
![]() ①
①
![]()
![]()
![]() ②
②
将①②两个反应相加时,得到这个反应的总离子方程式
![]()
(4)两盐的水解产物相互反应
弱碱强酸盐水解产生的 ![]() 与弱酸强碱盐水解产生的
与弱酸强碱盐水解产生的 ![]() 相互结合为
相互结合为 ![]() ,使两盐的水解反应得以完成。例如,
,使两盐的水解反应得以完成。例如, ![]() 溶液与
溶液与 ![]() 溶液混合,发生的反应为:
溶液混合,发生的反应为:
![]()
![]()
![]() ①
①
![]()
![]()
![]() ②
②
![]() ③
③
将①②③三个反应相加,便可得到 ![]() 溶液与
溶液与 ![]() 溶液混合时发生反应的离子方程式:
溶液混合时发生反应的离子方程式:
![]()
可溶性的铝盐、铁盐跟可溶性碳酸盐、酸式碳酸盐溶液混合时,均发生两盐水解产物的相互作用,生成 ![]() 或
或 ![]() 沉淀和
沉淀和 ![]() 气体。在此种情况下的离子反应方程式,要写等号“=”,
气体。在此种情况下的离子反应方程式,要写等号“=”, ![]() 、
、 ![]() 要写沉淀号“↓”,
要写沉淀号“↓”, ![]() 要写气体号“↑”。
要写气体号“↑”。
扩展资料
盐类水解的应用
(1) ![]() 等溶液的配制(可加
等溶液的配制(可加 ![]() 滴稀盐酸);
滴稀盐酸);
(2)长时间保存某些盐溶液,防止水解变质,常加几滴酸或碱;
(3)判断盐溶液中离子种类及浓度大小时考虑盐水解,如 ![]() 溶液中有
溶液中有 ![]() 、
、 ![]() 、
、 ![]() 、
、 ![]() 、
、 ![]() 、
、 ![]() ,其浓度大小为:
,其浓度大小为: ![]() ;
;
(4)泡沫灭火器的反应原理;
(5)化肥的施用,如铵态氮肥不能与草木灰混合施用:
![]()
![]()
![]()
(6)判断离子能否共存于同一溶液中,要考虑离子间能否发生双水解,如 ![]() 与
与 ![]() 、
、 ![]() 与
与 ![]() 、
、 ![]() 与
与 ![]() 、
、 ![]() 与
与 ![]() 、
、 ![]() 与
与 ![]() 、
、 ![]() 与
与 ![]() 、
、 ![]() 与
与 ![]() 等就不能大量共存。
等就不能大量共存。
(7)盐与盐溶液反应产物的判断;
(8)鉴别物质时考虑盐类双水解,如 ![]() 、
、 ![]() 、
、![]() 9种物质水溶液可用
9种物质水溶液可用
![]() 溶液鉴别。
溶液鉴别。
(9)制备胶体,如 ![]() 胶体的制备;
胶体的制备;
(10)明矾、绿矾净水;
(11) ![]() 作焊药;
作焊药;
(12)用于判断盐溶液显酸性或中性或碱性,如 ![]() 溶液的碱性比
溶液的碱性比 ![]() 溶液的碱性强;
溶液的碱性强;
(13)判断盐溶液中水的电离度的大小;
(14)苏打粉用于面粉的发酵;
(15)制取某些无水盐,如用 ![]() 制无水
制无水 ![]() 。
。
扩展资料
离子浓度大小比较的方法
离子浓度大小的比较,是历年高考命题的热点。它涉及的知识点多,综合性强,需平时进行强化训练。
电解质溶液中离子浓度的相对大小的题目,概括起来有以下几种类型:
(l)一种电解质溶液中各种离子浓度的相对大小比较;
(2)相同浓度的不同电解质溶液pH大小比较(实质上是 ![]() 或
或 ![]() 的大小比较);
的大小比较);
(3)两种电解质溶液混合后各种离子浓度大小比较;
(4)一种电解质加入不同电解质溶液中比较溶液导电能力的大小(实际上是比较溶液中总离子浓度的大小);
要解决离子浓度的大小问题,必须牢固地掌握以下知识点:
(l)电解质的电离;
(2)弱电解质的电离平衡;
(3)盐类的水解;
(4)溶液的导电性与离子浓度的关系;
(5)电解质间的相互反应。
其中还要掌握两个守恒关系:
(l)质量守恒(物质的量或物质的量浓度守恒);
(2)电荷守恒(溶液中各阳离子的正电荷总量与阴离子的负电荷总量相等)。
明矾的净化
明矾的化学成份是 ![]() 。将明矾溶于水时,
。将明矾溶于水时, ![]() ,另外
,另外 ![]() 还将发生水解:
还将发生水解: ![]()
![]()
![]() ,会产生胶状
,会产生胶状 ![]() 。
。 ![]() 有较强吸附作用,吸附溶液悬浮杂质一同沉淀,起到净化水的作用,但不能软化水,因它不能减少水中
有较强吸附作用,吸附溶液悬浮杂质一同沉淀,起到净化水的作用,但不能软化水,因它不能减少水中 ![]() 、
、 ![]() 。
。
盐溶液的配制和结晶
如 ![]() 、
、 ![]() 等盐溶液的配制时,常在盐溶液中加入少量盐酸,以抑制
等盐溶液的配制时,常在盐溶液中加入少量盐酸,以抑制 ![]() 、
、 ![]() 等的水解防止溶液出现浑浊现象,减少盐溶液的杂质。
等的水解防止溶液出现浑浊现象,减少盐溶液的杂质。
如加热 ![]() 水溶液制备
水溶液制备 ![]() 的晶体时,常边加热边向容器中通以氯化氢气体的气流,同样是防止
的晶体时,常边加热边向容器中通以氯化氢气体的气流,同样是防止 ![]() 的水解,防止
的水解,防止 ![]() 转化成
转化成 ![]() ,以得到
,以得到 ![]() 的晶体。
的晶体。 ![]()
![]()
![]() 。
。
如直接加热蒸发 ![]() 、
、 ![]() 、
、 ![]() 等盐溶液,都得不到无水
等盐溶液,都得不到无水 ![]() 、无水
、无水 ![]() 及无水
及无水 ![]() ,原因是加热促进了它们的水解,使它们转化成了相应的氢氧化物
,原因是加热促进了它们的水解,使它们转化成了相应的氢氧化物 ![]() 、
、 ![]() 、
、 ![]() 。若进一步加热可得到相应氧化物
。若进一步加热可得到相应氧化物 ![]() 、
、 ![]() 、
、 ![]() 。
。