 设为首页
设为首页
 加入收藏
加入收藏
目标与要求
知识与技能
l 了解原子是由质子、中子和电子构成的;了解原子的实际质量和相对原子质量的意义,并会查相对原子质量表。
过程与方法
l 通过数据信息的分析比较,对获取的信息进行加工处理,提炼规律。
情感态度与价值观
l 初步建立“世界是物质的、物质是可分的”的辩证唯物主义认识观;对学生进行爱国主义思想教育。
l 通过原子构成的认识,培养学生空间想象能力和抽象思维能力。
设计与建议
1、展示原子构成实物模型图,分析原子构成。原子的发现史及原子学说的建立。
2、读一读、议一议表4-2,提问学生你有哪些发现?讨论争辨,提出猜想:①质子数=核外电子数,②③④……
3、原子的体积。列数字,打比喻。力求形象生动。
4、不算不知道,一算吓一跳。
5、相对原子质量。查一查,想一想课后习题第3、4题。
6、科学院院士张青莲教授。
7、回忆本节课内容,先想一想,再看一看P70 “学完本课你应该知道”哪些方面的知识。
8、写一写:写一篇介绍原子构成的科普小文与同学们交流。
9、开拓视野,读一读——中子星、原子学说的起源
情景素材
![]() 原子结构规律的探究
原子结构规律的探究
已知每个电子的质量约为每个质子(或中子)质量的 1/1836。下表选自教材 P68 表4-2:几种原子的构成。通过此表,可总结出“在原子里质子数等于核外电子数”。”
|
原子种类 |
质子数 |
中子数 |
核外电子数 |
相对原子质量 |
|
氢 |
1 |
0 |
1 |
1 |
|
碳 |
6 |
6 |
6 |
12 |
|
氧 |
8 |
8 |
8 |
16 |
|
钠 |
11 |
12 |
11 |
23 |
|
铁 |
26 |
30 |
26 |
56 |
你还能总结出:
⑴ ;
⑵ ;
⑶ ;
⑷ 。
解析:此题主要考查不同原子结构中各种量之间的等量关系。解题时,运用分析比较的方法对照表中所给的一组信息,分析上下左右之间的关系。本题中质子数、中子数、核外电子数、相对原子质量的相互关系;各元素的质子数或中子数或电子数或相对原子质量等数据规律,从中总结出规律性的结论。本题解题思路如下:
1、由第一纵行以及纵行间对比、分析数据,整理后发现规律:第一纵行的不同原子,其质子数不同,即质子数决定元素种类。第二纵行,氢原子没有中子,其他原子中子数也不一定相同,即原子核内中子数≥0,或不是所有原子都含有中子。由纵行对比看:原子核内中子数不一定等于中子数,或原子核外电子数不一定等于中子数。或一般说来:相对原子质量随质子数或中子数增加而增大。
2、由每一横行以及横行间对比、分析数据,整理后发现规律:
原子核内质子数等于核外电子数;相对原子质量=质子数+中子数
答案:(1)相对原子质量=质子数+中子数;(2)原子核内质子数不一定等于中子数;(3)原子核内质子数决定元素种类;(4)不是所有原子都含有中子(或原子核内中子数≥0)……
误区分析
解答本题时往往会出现以下几种错误:(1)对表中某一数据或某一组数据,未经分析、整理就下结论。如“氢原子中没有中子”,只说明了特殊性,而未上升到普遍规律,可改为“不是所有原子都有中子”。又如“碳原子、氧原子核内质子数=中子数”,可改为“不是所有原子核内的质子数都等于中了数”。(2)对某一规律性的结论进行变式处理,变成另一规律性结论,尽管正确,但算重复结论。如“相对原子质量=质子数+中子数”或“相对原子质量—中子数=质子数”。(3)不从所给信息出发,违背题意答。如有学生得出如下结论:分子在化学变化中可分,而原子在化学变化中不可分。(4)违背科学事实,臆造结论。
1、下表选自教材 P68 表4-2:几种原子的构成。已知每个电子的质量约为每个质子(或中子)质量的 1/1836。
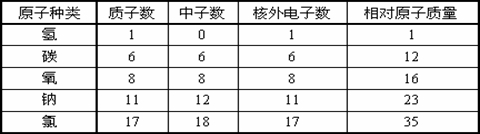
通过上表,可总结出“在原子里质子数等于核外电子数”,你还有哪些发现:
⑴ ;⑵ ;
⑶ ;⑷ 。
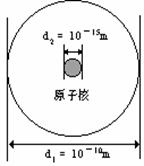 2、趣味计算:我们已经知道原子的质量主要集中在原子核上,原子核的半径约为原子半径的 1/100000,一个质子(或中子)的质量约为 1.67×10-27 kg。假设右图为氢原子构成示意图,若 1 cm3 (=10-6 m3)的容器内装入的全部是氢原子核,粗略计算一下其质量约为多少?假若“国贸大夏”(体积按30000m3计算)内装入的全部是氢原子核,质量又是多少?和月球的质量(约 7.35×1022 kg)相比较,哪个大?你听说过“中子星”和“黑洞”吗?查一查资料,你对原子又有了哪些新的认识。(V球= 4/3πr3)
2、趣味计算:我们已经知道原子的质量主要集中在原子核上,原子核的半径约为原子半径的 1/100000,一个质子(或中子)的质量约为 1.67×10-27 kg。假设右图为氢原子构成示意图,若 1 cm3 (=10-6 m3)的容器内装入的全部是氢原子核,粗略计算一下其质量约为多少?假若“国贸大夏”(体积按30000m3计算)内装入的全部是氢原子核,质量又是多少?和月球的质量(约 7.35×1022 kg)相比较,哪个大?你听说过“中子星”和“黑洞”吗?查一查资料,你对原子又有了哪些新的认识。(V球= 4/3πr3)
3、展开你想象的翅膀,发挥你的聪明睿智,亲自动手制作一个原子模型,然后你“钻”进去,遨游原子“狭小”而又“宽广”的天空,写一篇介绍原子构成的科普小文与同学们交流。要求:通俗易懂,文笔流畅,400 字左右。
4、开拓视野,读一读
(只举一例,由学生查阅,班上交流)
中子星
你想象过如果原子“坍塌”,会是什么情形?
我们知道,原子是由原子核和电子组成的,原子的质量绝大部分集中在原子核上,而原子核的体积很小。比如氢原子的半径为一亿分之一厘米,而氢原子核的半径只有十万亿分之一厘米。假如核的大小象一颗玻璃球,则电子轨道将在两公里以外。而在巨大的压力之下,电子将脱离原子核,成自由电子。这种自由电子气体将尽可能地占据原子核之间的空隙,从而使单位空间内包含的物质也将大大增多,密度大大提高了。形象地说,这时原子核是“沉浸于”电子中。中子星就是这样形成的。
 在中子星里,压力是如此之大,电子被压缩到原子核中,同质子中和为中子,使原子变得仅由中子组成。而整个中子星就是由这样的原子核紧挨在一起形成的。可以这样说,中子星就是一个巨大的原子核。中子星的密度就是原子核的密度。中子星的密度为1011kg/cm3, 也就是每立方厘米的质量竟为一亿吨之巨! 事实上,中子星的质量是如此之大,半径十公里的中子星的质量就与太阳的质量相当了。
在中子星里,压力是如此之大,电子被压缩到原子核中,同质子中和为中子,使原子变得仅由中子组成。而整个中子星就是由这样的原子核紧挨在一起形成的。可以这样说,中子星就是一个巨大的原子核。中子星的密度就是原子核的密度。中子星的密度为1011kg/cm3, 也就是每立方厘米的质量竟为一亿吨之巨! 事实上,中子星的质量是如此之大,半径十公里的中子星的质量就与太阳的质量相当了。
中子星是处于演化后期的恒星,它是在老年恒星的中心形成的。只不过能够形成中子星的恒星,其质量更大罢了。根据科学家的计算,当老年恒星的质量大于十个太阳的质量时,它就有可能最后变为一颗中子星,而质量小于十个太阳的恒星往往只能变化为一颗白矮星。
当恒星外壳向外膨胀时,它的核受反作用力而收缩。核在巨大的压力和由此产生的高温下发生一系列复杂的物理变化,最后形成一颗中子星内核。而整个恒星将以一次极为壮观的爆炸来了结自己的生命。这就是天文学中著名的“超新星爆发”。
请回答:
1、通过阅读,你对原子又有了哪些新的认识?
2、你想了解“黑洞”和“白洞”吗?请上网浏览宇宙探秘(http://www.hongen.com.cn/art/twdg/index.htm)。还有更惊讶的内容等着你。
教学建议
1、关于原子构成的教学。由于原子的体积的是那么的小,学生对微观领域的粒子缺乏感性认识,所以应尽可能使用电教手段,将原子的结构直观而形象地展示出来。许多网站上提供了大量用 Flash 化学课件示例和一些老师精彩的课件专辑。老师们可以通过上网下载到自己想要的积件或课件。现提供几个著名的课件资源Web网站:
l 中国教育先锋网(http://www.epchina.net/)中的“课件基地”;
l 中学化学教学资源网(http://hff.21cn.com:91/)中的“课件素材”;
l CAI 爱好者(http://sq.k12.com.cn/~wanyanming)中的“课件资源”;
l 中学化学课件网(http://Chemcai.myrice.com/)中“课件素材”。
l 如果实在没有条件,也可以自己亲自制作一个实物模型在课堂上进行讲解,或由学生事先自己在家制作,然后收集起来,用学生自己制作的模型“现身说法”,更具亲和力和吸引力。
2、关于表4-2《几种原子的构成》的使用。表中提供了五种原子的数据信息,这是一个创设“问题情景”的极好的信息源,教师应该充分加以利用,引导学生从数据信息中概括出有用的规律性东西。只要引导得法,学生是不难得出结论的。
3、关于原子体积的教学。应充分发挥图4-2的功用。同时,为了使本节课枯燥的内容行动有趣,增强学生对原子体积很小但原子中又有一个很大空间的正确认识,不妨来一个“不算不知道,一算吓一跳”的趣味计算。
4、关于相对原子质量的教学。不要求掌握相对原子质量是怎么计算来的,只要求学生会查相对原子质量表。但应强调相对原子质量的大小反映了原子实际质量的大小。
5、重视化学史的教学。主要是对原子构成的认识以及我国张青莲教授在相对原子质量测定上的卓越贡献。

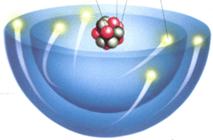
原子的构成示意图 原子结构模型图
原子是怎样构成的?
原子是由居于原子中心带正电的原子核和核外带负电的电子构成。原子核是由质子和中子构成的。
质子、中子和电子是构成原子的三种微粒,它们之间的性质差异可用下表表示。
|
粒子种类 |
电 性 |
质 量 |
|
质子 |
1个单位正电荷 |
1.6726X10-27kg |
|
中子 |
不带电 |
1.6749X10-27kg |
|
电子 |
1个单位负电荷 |
质子质量的1/1836 |
本课题小结:
1、原子核中有质子和中子,是一个微粒的集合体,尽管它很小,也不能再称为微粒。
2、原子是由原子核和核外电子构成的。原子核居于原子的中心,带正电,是由带正电的质子和呈电中性的中子构成的。原子核所带的正电荷数(又称核电荷数)等于核内的质子数。质子数与核外电子数相等,原子核所带的电量与核外电子的电量相等、电性相反,原子作为一个整体不显电性。原子是很小的微粒,原子核更小,它的半径约为原子半径的万分之一。质子的质量和中子的质量大致相等,电子的质量约为质子质量的1/1836,原子的质量主要集中在原子核上。电子在原子核外空间里围绕着原子核作高速运动。
|