 设为首页
设为首页
 加入收藏
加入收藏
一、探究目标
(一)知识技能
1、理解化学能与电能之间转化的实质。
2、掌握化学能是能量的一种形式,它同样可以转化为其他形式的能量。
(二)过程与方法
通过反应物之间电子的转移的探究,理解原电池的形成是氧化还原反应的本质的拓展和运用。
(三)情感价值观
感悟研制新型电池的重要性以及化学电源可能会引起的环境问题,形成较为客观、正确的能源观,提高开发高能清洁燃料的意识。
二、探究重点
初步认识原电池概念、原理、组成及应用。
三、探究难点
通过对原电池实验的研究,引导学生从电子转移角度理解化学能向电能转化的本质,以及这种转化的综合利用价值。
四、探究过程
【实验探究引入课题】
|
实 验 步 骤 |
现 象 |
| 1、锌片插入稀硫酸 | |
| 2、铜片插入稀硫酸 | |
| 3、锌片和铜片上端连接在一起插入稀硫酸 |
【问题探究】
1、锌片和铜片分别插入稀硫酸中有什么现象发生?
2、锌片和铜片用导线连接后插入稀硫酸中,现象又怎样?为什么?
3、锌片的质量有无变化?溶液中c (H+)如何变化?
4、锌片和铜片上变化的反应式怎样书写?
5、电子流动的方向如何?
【引入】
电能是现代社会中应用最广泛,使用最方便、污染最小的一种二次能源,又称电力。例如,日常生活中使用的手提电脑、手机、相机、摄像机……这一切都依赖于电池的应用。那么,电池是怎样把化学能转变为电能的呢?这就让我们用化学知识揭开电池这个谜。
【板书】 第二节 化学能与电能
【板书】一、化学能与电能的相互转化
【板书】1、燃煤发电的过程

【板书】2、燃烧的本质──氧化还原反应
【分析】氧化还原反应的本质是氧化剂与还原剂之间发生电子转移的过程,电子转移引起化学键的重新组合,伴随着体系能量的变化。要使氧化还原反应释放的能量不通过热能而直接转化为电能,就要设计一种装置,使氧化反应和还原反应分别在两个不同的区域进行。如果要把可产生的电能以化学能的形式储存起来,这就是我们这节课要研究的重要知识点──原电池,这种装置可以将氧化还原反应的能量储存起来,类似于水库的蓄能。
【板书】3、原电池
原电池实验探究

【学生探究】探究实验,填写下列表格。
|
现 象 | |
| 铜 片 | |
| 锌 片 | |
| 电流表 |
【学与问】根据你所了解的电学知识,你知道电子是怎样流动的吗?你如何判定装置的正、负极?
【动画模拟】原电池的微观原理
【分析】当把用导线连接的锌片和铜片一同浸入稀硫酸中时,由于锌比铜活泼,容易失去电子,锌被氧化成Zn2+而进入溶液,电子由锌片通过导线流向铜片,溶液中的H+从铜片获得电子被还原成氢原子,氢原子再结合成氢分子从铜片上逸出。这一变化过程可以表示如下:
锌片:Zn - 2e- = Zn2+ (氧化反应)
铜片:2H+ + 2e- = H2↑ (还原反应)
总反应:Zn+2H+ = Zn2+ + H2↑
【板书】(1)原电池的定义──将化学能转变为电能的装置叫做原电池。
【板书】(2)原电池的电极
负极:发生氧化反应,电子流出(流向正极)的一极。
正极:发生还原反应,电子流入(来自负极)的一极。
【学生探究活动】根据铜锌原电池,填写下表:
|
电极 |
电极材料 |
电极反应 |
反应类型 |
得失电子的粒子 |
电子流动方向 |
|
负极 |
|||||
|
正极 |
总反应:________________________________________________________
【学生探究练习】动画模拟
引出组成原电池需要的条件
【板书】(3)组成原电池的条件
①有两种活动性不同的金属(或一种是非金属导体)作电极。
②电极材料均插入电解质溶液中(能自发进行氧化还原反应)。
③两极相连形成闭合电路。
【板书】(4)原电池的原理:
较活泼的金属发生氧化反应,电子从较活泼的金属(负极)流向较不活泼的金属(正极)。

【实践活动】课本P.37根据构成原电池的条件可知:利用水果如苹果、柑橘、柠檬或番茄等都可以制作原电池。
【练习巩固】
1.X、Y、Z都是金属,把X浸入Z的硝酸盐溶液中,X的表面有Z析出,X和Y组成原电池时,Y为电池的负极。X、Y、Z三种金属的活动性顺序为( )
(A)X>Y>Z (B)X>Z>Y (C)Y>X>Z (D)Y>Z>X
2.下列装置哪些可以形成原电池? 形成原电池的写出电极反应式,并指出电子流动方向。
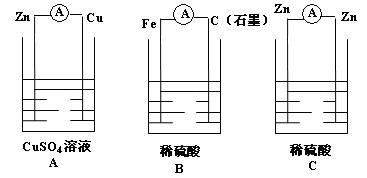
【小结】
化学电池的反应本质是──氧化还原反应

【作业】
1、课本P.36 “科学探究”
2、完成“课课测评” 卷5 P.9~10
|