 设为首页
设为首页
 加入收藏
加入收藏
“血红蛋白的提取和分离”是人教版选修模块《生物技术实践》中的实验内容,其目的是使学生体验从复杂细胞混合物体系中提取生物大分子的基本原理、过程和方法,该实验虽然操作难度较大,但原理清晰,动手机会较多,因此,学生的学习兴趣很高。下面结合人教版教材对该实验进行分析并提出相应的教学建议。
1.习得实验原理和方法
1.1 初步获取血红蛋白的原理和方法(样品的处理和粗分离)
|
实验步骤 |
实验目的 |
实验原理 |
操作方法 |
结果判断 |
|
①洗涤红细胞 |
获取较纯净的红细胞 |
通过离心将密度不同的物质分离 |
低速离心,去除上清液,反复加生理盐水并离心 |
直到上清液未呈现黄色为止 |
|
②释放血红蛋白
|
破裂红细胞,释放血红蛋白 |
低渗溶液中红细胞破裂;甲苯溶解膜脂,加速细胞破裂(相似相溶原理) |
加蒸馏水,再加甲苯,磁力搅拌器充分搅拌 |
无明显现象 |
|
③分离血红蛋白溶液 |
初步得到血红蛋白溶液 |
通过离心将密度不同的物质分离 |
离心(较高速) |
试管溶液分为4层 |
|
④透析 |
去掉液体中的小分子物质 |
小分子物质容易透出透析袋 |
透析(12小时) |
透析袋中物质的颜色更红 |
1.2 分离纯化蛋白质的原理与方法──凝胶色谱法(分子筛效应)
凝胶是一些由多糖类化合物构成的多孔球体,当相对分子质量不同的蛋白质通过凝胶时,相对分子质量较小的蛋白质直径小于凝胶网孔,由于静电吸附和扩散作用容易进入凝胶内部的通道,可以自由地进入凝胶颗粒的网孔,在向下移动的过程中,它们从凝胶颗粒的网孔扩散到凝胶颗粒间的孔隙,再进入另一凝胶颗粒的网孔,如此不断地进出,使流程增长,而最后流出层析柱。而相对分子质量较大的蛋白质无法进入凝胶颗粒的网孔,只能沿着凝胶颗粒间的孔隙,随着洗脱液流动,流程较短,因此首先流出层析柱。分子量介于二者之间的物质,虽然能够进入凝胶网孔,但比小分子难,因此进入凝胶网孔的几率比小分子小,向下移动的速度比小分子快,而比大分子慢。相对分子质量不同的蛋白质分子因此得以分离。
需要注意的是,有部分小分子蛋白质未进入凝胶内部,而在外部移动,因此,如果需要得到纯度更高的蛋白质分子,可将色谱柱中的凝胶溶液进行平衡后进行再次冼脱和分离。
1.3 鉴定蛋白质纯度的原理与方法──电泳
蛋白质分子的基本单位是氨基酸,氨基酸的一些基团在一定的pH下会发生水解或电离从而带有电荷。但总的来说蛋白质分子一般带有负电。在电场的作用下,带电的蛋白质分子会向着电泳槽中的正极方向移动。由于样品中各种蛋白质分子净电荷的量的差异以及蛋白质分子本身的大小等因素,使蛋白质分子产生不同的迁移速率,从而将样品中各种蛋白质分子分离开。
由于蛋白质分子带电电荷比较复杂,净电荷总量与蛋白质分子的质量不成正比,而蛋白质分子的质量又是衡定的,电泳时在带电量和分子质量两种因素的作用下会产生迁移速率的复杂化,不能正确地将分子质量不同的蛋白质分子分离开,因此,实际操作中,一般会将蛋白质分子与SDS(十二烷基硫酸钠)发生反应形成蛋白质—SDS复合物,由于SDS所带负电荷的量大大超过蛋白质分子原有的电荷量,因此掩盖了不同种蛋白质间的电荷差异,使蛋白质的迁移率完全取决于蛋白质分子质量的大小。在电场条件下,分子量大的蛋白质迁移率慢,离前沿较远,而分子量小的蛋白质迁移快,离前沿较近。这样,不同分子量大小的蛋白质得到了分离。如果蛋白质的纯度高,迁移率一致,就会形成前沿整齐、清晰的条带。
2.正确定位教学目标
以上原理和方法中,“初步获取血红蛋白的原理和方法”比较简单,又有必修的基础,因此学生容易理解;凝胶色谱法的原理容易理解,但操作复杂,难度较高,是学生学习的重点;电泳的原理和方法比较复杂,绝大多数学校目前缺乏相应的实验设备,而且是用于鉴定分离后蛋白质纯度的后续实验,因此可作为选学内容。基于以上分析,特确定如下的教学目标、教学的重点和难点。
2.1 教学目标
(1)说出从血液中初步获取血红蛋白的原理和方法。
(2)说明凝胶色谱法的原理和方法。
(3)说出电泳的基本原理和方法。
(4)进行样品的预处理。
(5)运用凝胶色谱法对血红蛋白进行分离纯化。
2.2 教学重点和难点
教学重点:凝胶色谱法的原理和方法。
教学难点:样品的预处理;色谱柱的装填;纯化分离操作。
3.实验前准备
3.1 几种重要实验试剂的配制及注意事项
3.1.1 磷酸缓冲液(20mmol/L)的配制及注意事项
|
配制步骤 |
配制的溶液 |
配制方法 |
注意事项 |
|
① |
0.2 mol/L的Na2HPO4溶液 |
将71.64 g 的Na2HPO4·12H20充分溶解于1000 mL的蒸馏水中 |
在混合两种溶液时,注意用酸度计或pH试纸检测,并调节溶液的pH在7.0左右 |
|
② |
0.2mol/L的 NaH2PO4溶液 |
将 31.21 g 的NaH2PO4·2H20充分溶解于1000 mL的蒸馏水中充分溶解 | |
|
③ |
pH约为7.0的20mmol/L磷酸缓冲液 |
取61 mL步骤①中配制的Na2HPO4溶液与39 mL步骤②中配制的NaH2PO4溶液混合 |
3.1.2 丙烯酰胺和N, N-甲叉双丙烯酰胺的配制及注意事项
将29 g丙烯酰胺和1 g N, N-甲叉双丙烯酰胺溶于总体积为70 mL的水中,搅拌过夜使之充分溶解。注意事项:丙烯酰胺和双丙烯酰胺具有很强的神经毒性并可通过皮肤吸收,因此,操作时需要戴上手套和防毒面具,而且在通风橱内或通风处进行。价格较低的这两种药物中含有一些金属离子,为除去这些金属离子,可以在丙烯酰胺溶液中加入大约0.2倍体积的单床混合树脂,搅拌放置一夜后,再用Whatman 1号滤纸过滤就可以纯化。储存期间,由于光或碱的催化作用,丙烯酰胺和双丙烯酰胺会缓慢转化成丙烯酸和双丙烯酸,因此,应将配制好的溶液置于棕色瓶中,置于4 ℃保存,并且使用前应检查该溶液的pH,以确保pH不超过7.0。
3.1.3 SDS的配制及注意事项
将SDS用去离子水配制成10%的贮存液,于室温保存。注意事项:市售的SDS化学纯度不够,需要重结晶后使用。重结晶方法如下:称取20 g SDS,放入500 mL圆底烧瓶中,加半勺活性炭及300 mL无水乙醇,搅拌,摇匀。烧瓶上接一个小冷凝管。在水浴上加热至乙醇微沸,回流约10min,用热过滤漏斗趁热过滤。滤液应透明无色。滤液冷却至室温后,移至-20 ℃过夜。第二天,通过预冷的布氏漏斗抽滤,用少量-20 ℃无水乙醇洗沉淀3次,尽量抽干,将结晶置真空干燥器中干燥或40 ℃烘箱中烘干。
3.2 凝胶色谱柱的制作和装填
3.2.1凝胶色谱柱的制作
取长100cm,内直径1.6cm的玻璃管,两端需用砂纸磨平。底塞打孔→挖出凹穴→安装移液管头部→覆盖尼龙网,再用100目尼龙纱包好,插到玻璃管的一端。注意事项:底塞中插入的玻璃管的上部不得超出橡皮塞的凹穴底面,否则难以铺实尼龙网,还会导致液体残留,导致蛋白质分离不彻底。
3.2.2凝胶色谱柱的装填
计算并称取一定量的交联葡聚糖凝胶浸泡于蒸馏水或洗脱液中充分溶胀后,配成凝胶悬浮液。将色谱柱装置固定在支架上,将凝胶悬浮液一次性的装填入色谱柱内,凝胶沉集后,将溶剂放出至胶面不再下降,并且通过2~3倍柱床体积的溶剂(20mmol/L的磷酸缓冲液,pH 7.0)使柱床稳定。装填时轻轻敲动色谱柱,使凝胶填装均匀。装填完毕后,立即用缓冲液洗脱瓶,在50cm高的操作压下,用300 mL的20mmol/L的磷酸缓冲液(pH为7.0)充分洗涤平衡12h。注意事项:凝胶装填时尽量紧密,以降低凝胶颗粒之间的空隙;装填凝胶柱时不得有气泡存在,因为气泡会搅乱洗脱液中蛋白质的洗脱次序,降低分离效果;液面不要低于凝胶表面,否则可能有气泡混入,影响液体在柱内的流动,从而影响生物大分子物质的分离效果;注意不能发生洗脱液流干,露出凝胶颗粒的现象。
4.实验操作步骤及注意事项
本课题的主要目的是运用凝胶色谱法对蛋白质进行分离纯化,以下是实验操作流程。
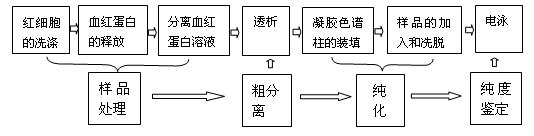
 样品的处理:取家兔一只,为保证取血量,取其颈动脉血,按1:1加入抗凝剂肝素(1250U/ mL)或适宜浓度的柠檬酸钠溶液(将6g柠檬酸钠溶于100 mL的生理盐水中),若要过夜,温度须控制在4 ℃左右。在样品处理的流程中,第一步用到低速离心,而第三步用到高速离心,这主要是因为血液中除有红细胞外,还有其他细胞及大量的物质,红细胞与这些物质之间的密度存在较大的差异,用低速离心就能将他们分离开;而“分离血红蛋白溶液”步骤中,溶液的主要成份的密度相对要接近些,因此需要用较高速的离心,才能将这些物质初步分离。
样品的处理:取家兔一只,为保证取血量,取其颈动脉血,按1:1加入抗凝剂肝素(1250U/ mL)或适宜浓度的柠檬酸钠溶液(将6g柠檬酸钠溶于100 mL的生理盐水中),若要过夜,温度须控制在4 ℃左右。在样品处理的流程中,第一步用到低速离心,而第三步用到高速离心,这主要是因为血液中除有红细胞外,还有其他细胞及大量的物质,红细胞与这些物质之间的密度存在较大的差异,用低速离心就能将他们分离开;而“分离血红蛋白溶液”步骤中,溶液的主要成份的密度相对要接近些,因此需要用较高速的离心,才能将这些物质初步分离。
搅拌好的混合液离心后明显分为4层(如右图),由上至下依次是甲苯层、脂溶性物质的沉淀层、血红蛋白的水溶液、红细胞破碎物沉淀。取其上清液,用滤纸过滤除去脂类,再使滤液在分液漏斗中静置5min,出现分层,分离出下层的血红蛋白溶液。
粗分离:将血红蛋白溶液装入规格为7000D的透析袋,按1:300的比例放入20mmol/L的磷酸盐缓冲液(pH为7.0),透析12h。透析的目的一是为了除去小分子蛋白质,二是使血红蛋白处于缓冲液环境中,便于后续的磷酸缓冲液在凝胶柱中进行洗脱。
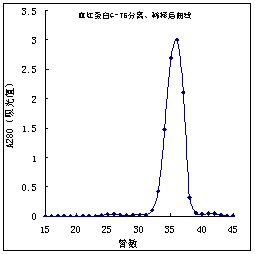
纯化:可采用柱型为Sephadex G75,柱体积为500 mL的色谱柱;加样量为10 mL(约含蛋白200 m g);用20mmol/L的磷酸盐缓冲液(pH为7.0)进行洗脱,洗脱速度可控制为0.5 mL /min,即20 min /管。此时可用A280的紫外线进行检测,如果测得的数值很高,说明蛋白含量过高,此时需要进行稀释。下图是将每管取0.5 mL稀释10倍后,用紫外线测量的结果(如下图)。
由图中数值可知,33-38管对应的数值为血红蛋白的吸收值,选择此时的试管进行蛋白质纯度的鉴定是比较合适的。
纯度鉴定:经聚丙烯酰胺凝胶电泳进行纯度鉴定,以下是实验操作流程。
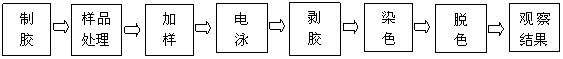
 脱色的目的是脱去背景颜色以体现出蛋白条带。一般来说,条带分明,目的条带清晰,无扩散,前沿比较直,说明实验结果比较好,样品比较纯,下面为兔血实验的电泳结果图。
脱色的目的是脱去背景颜色以体现出蛋白条带。一般来说,条带分明,目的条带清晰,无扩散,前沿比较直,说明实验结果比较好,样品比较纯,下面为兔血实验的电泳结果图。
5.课时安排及实施建议
本课题可安排4~5课时。教师可在实验前配制好磷酸缓冲液,并购买或制作好凝胶色谱柱,以备实验时使用。
|
课时安排 |
授课或实验内容 |
补充说明 |
|
第1~2课时 |
讲授凝胶色谱法和电泳的基本原理 |
透析和平衡凝胶需要的时间较长,可由教师完成; 电泳可由教师演示完成 |
|
第3课时 |
进行样品的处理(洗涤、释放、分离和透析) | |
|
第4课时 |
运用凝胶色谱法对血红蛋白进行纯化 | |
|
增加1课时 |
通过聚丙烯酰胺凝胶电泳对提取的蛋白质进行纯度鉴定 |
由于大多数学校缺乏相应的实验设备,操作难度较高,因此,本实验可由教师以讲清实验原理和演示操作为主,并配以相应的实验录像进行教学。
6.教学体会
本课题的实验操作相对复杂,影响实验效果的关键环节之一是凝胶色谱柱的制作和装填,对实验者的操作有很高的要求,建议有条件的学校直接购买商品色谱柱。由于甲苯是剧毒试剂,不太适合在中学实验中使用,因此,我们尝试在血红蛋白的释放时,只使用蒸馏水使细胞涨破,也获得了很好的实验效果。电泳过程中制胶、染色和脱色耗时较多,建议由教师完成,其他环节由师生共同完成。此外,本课题也可选用鸡血或猪血作为实验材料。
主要参考文献
1 朱正威,孙万儒,赵占良主编. 选修1生物技术实践. 北京:人民教育出版社,2007,7:64-70.
2 王镜岩,朱圣庚,徐长法主编. 生物化学. 北京:高等教育出版社,2005,4:298-312.
本文发自《生物学通报》09年第4期
|