设为首页
设为首页
 加入收藏
加入收藏
扩展资料
捕捉电子的人——汤姆逊
 英国科学巨匠、剑桥大学卡文迪许实验室主任J·J·汤姆逊是英国的著名物理学家,电子的发现者.20多年来一直试图揭开阴极射线的谜底,为此他进行了一系列实验.
英国科学巨匠、剑桥大学卡文迪许实验室主任J·J·汤姆逊是英国的著名物理学家,电子的发现者.20多年来一直试图揭开阴极射线的谜底,为此他进行了一系列实验.
在第一个实验里,汤姆逊在克鲁克斯管内的阳极上包了一层化学制品,这种制品一旦受到阴极射线的撞击就会发荧光.接着,他在阴极射线的路径上放了一个金属十字架.结果,他在阳极上看到了十字架的阴影.从这个实验中,汤姆逊得出结论:阴极射线是直线传播的.
第二步,汤姆逊在阴极射线的路径上放了一个精巧而又能转动的小“风车”(一种像排气扇的东西),发现阴极射线能够使“风车”转动.通过这一实验,汤姆逊了解到阴极射线是由物质的粒子构成的,而不仅仅是一束光线.
在第三个实验里,汤姆逊在克鲁克斯管周围加上一个磁场,把磁铁的北极和南极放在管子的两边.他观察到磁场使阴极射线或在阴极作用了下运动粒子的轨道弯曲了.这表明,粒子是带负电荷的.
在第四个实验里,汤姆逊把荷电板放在阴极射线的两边,测定使之弯曲所需的荷电量,由此他可以算出粒子的重量.汤姆逊发现,阴极粒子的重量约为已知量轻的元素氢原子的两千分之一.
最后,汤姆逊用不同的阴极把微量的不同气体放在各个管子内.他发现在每一种情况下,粒子所发生的变化都是一样的.因此他猜想,这些粒子是一切物质所共有的,而且始终是一样的.
就这样,汤姆逊得到了许多有关阴极射线的知识.他知道它们走的是直线,它们是物质的粒子,它们带负电荷,重量非常轻,而且在一切元素时里都可以发现它们.汤姆逊在深入研究这五个事实之后,于1897年4月30日就阴极射线做了一个说明.他在向皇家学会提出的报告中写道:“阴极射线是带负电荷的粒子.”由于这些粒子是来自原子里面,因此他得出结论:“原子不是不可分割的,带负电的粒子能够在电力作用下从原子里分裂出来.这些粒子不管是从哪种原子里分裂出来的,质量全都相同,而且带同样的负电荷,它们是一切原子的构成部分.”
多么惊人!100年来,大家都相信,原子是物质的最小单位,原子里面再没有别的东西,它是不能分割的.现在,按照汤姆逊的说法,他发现了能够在每一种原子里都能找到的粒子.他把这些粒子叫做电子,意思是带电的粒子.电子很轻,汤姆逊后来测出电子仅占原子总重量的1/1400左右.
汤姆逊根据这些实验结论假设了一个原子模型——葡萄干面包模型.他认为原子是一个带正电的球(面包),在这个球里面散布着很小的带负电的电子(葡萄干),这些电子排成一层一层的环.
1906年,汤姆逊因测出电子的电荷与质量而获诺贝物理奖.
扩展资料
查德威克
一、生平简介
查德威克,J.(Sir James Chadwick1891~1974)英国实验物理学家.1891年10月20日生于曼彻斯特,1911年毕业于曼彻斯特大学,后又在柏林大学和剑桥大学深造.1923~1935年在剑桥大学任教.1935~1948年任利物浦大学教授.1948年起任剑桥大学戈维尔和凯尔斯学院院长.1927年当选为英国皇家学会会员.剑桥、牛津等许多大学都授予他荣誉学位.1945年被封为爵士.他是E.卢瑟福的学生和亲密的同事.
他还获得伯明翰大学、都柏林大学、利物浦大学、爱丁堡大学等许多学校的博士学位,他还是布鲁塞尔、丹麦、阿姆斯特丹等许多科学院的院士,他还获得法拉第奖章和富兰克林奖章等.1974年7月24日,这位现代物理学的先驱者与世长辞,终年83岁.
二、科学成就
查德威克主要从事原子核物理学的实验研究.1914年他是学生的时候,首先发现β射线能谱是连续的.1920年他通过铂、银和铜核研究α粒子的散射,直接测出了原子核的电荷,从而完全证实了卢瑟福的原子理论和关于元素的核结构以及核电荷数与元素的原子序数相等的结论.
查德威克对科学的最大贡献是他发现了中子.
1930年德国的W.W.G.博特用氦核轰击铍观察到一种穿透性很强的辐射,当时称之为铍辐射.其后,约里奥-居里夫妇用这种铍射线轰击石蜡和其它含氢物质,观察到石蜡中放射出一种强质子流.由于当时错误地认为这种铍辐射是一种γ辐射,从而对这种质子流的放射现象难以解释.这时查德威克也一直在进行铍福射的研究,根据约里奥-居里夫妇的实验,他敏锐地觉察到铍福射决不是γ辐射,很可能就是卢瑟福在1920年所预言的、也是他多年寻找的—中子辐射.查德威克通过一系列实验研究,最后终于证实了中子的存在,铍福射即是由铍中射出的中子组成的.于1932年在《自然》上发表了《中子可能存在》的专文.
查德威克发现了中子,不仅改变了当时人们的物质结构的概念,同时还为研究和变革原子核提供了一种有力的手段,促进了核裂变研究工作的发展和原子能的利用.由于这一重要的发现,他获得了1935年诺贝尔奖物理学奖.
查德威克与卢瑟福和C.D.艾利斯合着《放射性物质的放射》一书,于1930年出版.
三、趣闻轶事
1、战俘营里的实验室
1914年第一次世界大战爆发,德、英两国成为敌对国,正在柏林的查德威克被德国当局当作英国“俘虏”拘押在鲁莱本的一个战俘集中营.据说查德威克在集中营里开始闷得发慌,找不到知音.后来来了一位英国青年军官埃利斯,查德威克以极大的热情向埃利斯讲解原子物理.战后埃利斯成了一个原子物理学家.他这种科学精神深得德国同行们的同情和赞赏.在德国科学院的努力交涉下,查德威克在集中营里建立起一座实验室,坚持作放射性实验研究.
2、老师无意学生有心
1920年圣诞节,卢瑟福在向少年儿童作有关原子物理学科普报告的时候,曾经提出一个很有启发性的问题,既然原子中有带负电的电子,也有带正电的质子,为什幺就不可以有一种不带电的中性粒子呢?问者无意,听者有心.当时在场的查德威克对中性粒子产生了兴趣,从1921年起,他就从实验和理论两方面着手寻找中子.他指导格拉逊和罗伯茨从氢气放电实验中寻找,结果没有成功.1932的法国物理学家约里奥·居里夫妇用钋源中的α粒子轰击铍靶,产生穿透本领强的射线,用这种射线照射石蜡,发现石蜡经撞击后发射出质子来.他们误认为这种射线是γ射线,γ射线有一种新的作用,可以把石蜡中的质子打出来.查德威克以特有的敏感性感到需要重新审查这一实验结果,他发现这种射线的速率只有光速的1/10,不可能是γ射线.于是,他一方面用弹性碰撞的理论来分析,根据碰撞过程中的能量和动量守恒,确认这种中性射线是质量很大的中性粒子;中一方面用实验测得这种中性粒子的质量和氢核的质量几乎相等.就这样,查德威尔克终于在1932年发现了这种中性粒子,他采纳了美国化学家哈金斯的建议,把这种中性粒子叫做中子.
3、与劳伦斯的友情
查德威克于1932年发现了中子,中子的发现打开了原子核的大门,使原子核物理学有了划时代的进展,他因此荣获了1935年诺贝尔物理奖.美国物理学家劳伦斯由于发明了回旋加速器,为高能物理的研究提供了有力的实验工具,找到了打开粒子物理世界的一把钥匙,而荣获了1939年的诺贝尔物理奖.这两位不同国度的杰出物理学家在1933年索尔维会议上不期而遇,随后开始了热情的通信,进而成为亲密的朋友.
1939年7月,由于劳伦斯的大力倡导,并派助手协助,查德威克在利物浦的回旋加速器终于产生了它的第一束加速粒子.
在劳伦斯的助手瓦尔克的协助下,金赛承担了加速器的日常管理工作,金赛毕业于剑桥大学,他在卡文迪许实验室工作学习了一段时间以后,和劳伦斯一起工作了3年.
1943年,查德威克率领一英国科学家来到美国的洛斯阿拉莫斯,参加原子弹的研制工作.查德威克与劳伦斯,通过他们的书信往来成为亲密的朋友,在初次见面十年以后,他们在曼哈顿工程中再次相会,重温旧好.为了科学的发展、世界的和平、人类文明的进步,他们开始并肩工作。
扩展资料
卢瑟福
卢瑟福(Ernest Rutherford,1871~1937)1871年8月30日生于新西兰纳尔逊附近的泉林村.父亲是农民和工匠,母亲是乡村教师.他在小学就对科学实验产生了兴趣.由于成绩优秀,学习期间曾获一系列奖学金.1894年从坎特布雷学院毕业时,以该校空前的数学和物理双第一名的成绩获硕士学位,还因无线电实验研究方面的成绩获理学学士学位.毕业后,留校工作一年.1895年考取大英博览会奖学金,进英国剑桥大学卡文迪什实验室学习.开始时是以研究无线电为主,用自己的发射器和检波器实现了3.2km的收发距离.意大利人马可尼后来的成就中包括了对卢瑟福检波器的改进,但卢瑟福不计较个人名利,未与马可尼争无线电发明的优先权,在1932年5月3向马可尼颁发奖章时还赞扬了马可尼的功绩.
1896年春末,卢瑟福接受卡文迪什实验室主任J.J.汤姆孙的建议,把研究方向转到放射性上.1897年卢瑟福发现,铀射线由两种成分组成,一种是易被吸收的射线,他称之为
![]() 射线;另一种是穿透性强的射线,他称之为
射线;另一种是穿透性强的射线,他称之为 ![]() 射线.同时他还根据实验预言,可能存在一种穿透能力更强的射线,这就是后来发现的并由他命名的
射线.同时他还根据实验预言,可能存在一种穿透能力更强的射线,这就是后来发现的并由他命名的
![]() 射线.
射线.
卢瑟福1898年在卡文迪什实验室研究生毕业后,由J.J.汤姆孙推荐,到加拿大的麦吉尔大学任物理学教授.除教学之外,他继续研究放射性.与来自英国的青年化学家F·索迪合作,于1902年首先发现了放射性元素的半衰期,提出放射性是元素自发衰变现象,指出放射性和光谱实验表明了原子有一个很复杂的结构.1903年5月,他和索迪根据
![]() 射线和
射线和 ![]() 射线在电场和磁场中的偏转度,辨别出它们分别由带正、负电的粒子构成.指出放射性元素的原子衰变时释放带电粒子而变成性质不同的新元素,列出了早期的镭、钍、铀的衰变图谱,确认
射线在电场和磁场中的偏转度,辨别出它们分别由带正、负电的粒子构成.指出放射性元素的原子衰变时释放带电粒子而变成性质不同的新元素,列出了早期的镭、钍、铀的衰变图谱,确认
![]() 射线的能量占放射性元素辐射能量的99%以上,为他们后来以
射线的能量占放射性元素辐射能量的99%以上,为他们后来以
![]() 射线作为研究原子结构的炮弹提供了根据.1905年他应用放射性元素的含量及其半衰期,计算出太阳的寿命约为50亿年,开创了用放射性元素半衰期计算矿石、古物和天体年纪的先河.
射线作为研究原子结构的炮弹提供了根据.1905年他应用放射性元素的含量及其半衰期,计算出太阳的寿命约为50亿年,开创了用放射性元素半衰期计算矿石、古物和天体年纪的先河.
卢瑟福在放射性研究上取得的一系列重大成果,使他名扬于世.1907年他谢绝了一些著名大学的高薪聘请,而出任英国曼彻斯特大学的物理学教授,因为该校有设备先进的实验室和优越的科研条件.卢瑟福对
![]() 、
、 ![]() 、
、 ![]() 射线作了大量的研究.1908年,他测算出
射线作了大量的研究.1908年,他测算出 ![]() 射线的电荷.1913年,他提出
射线的电荷.1913年,他提出 ![]() 粒子的带电量为2
粒子的带电量为2 ![]() ,原子量为3.84,认为
,原子量为3.84,认为 ![]() 粒子失去电荷后应变成氦原子.1913~1914年,他与人合作,测定
粒子失去电荷后应变成氦原子.1913~1914年,他与人合作,测定
![]() 射线的性质和波长,确认
射线的性质和波长,确认 ![]() 射线是一种比X射线频率更高的电磁辐射.
射线是一种比X射线频率更高的电磁辐射.
卢瑟福早就有用 ![]() 射线探索原子结构的想法.1903年他就发现
射线探索原子结构的想法.1903年他就发现 ![]() 射线的能量比
射线的能量比 ![]() 和
和 ![]() 射线大99倍左右,1906年他又发现
射线大99倍左右,1906年他又发现 ![]() 射线通过云母片时,出现偏转2º的小角度散射现象.1908年6月,盖革发现.射线的散射角与靶材料的原子量成正比
.同年10月,布拉格写信给卢瑟福,告诉他用
射线通过云母片时,出现偏转2º的小角度散射现象.1908年6月,盖革发现.射线的散射角与靶材料的原子量成正比
.同年10月,布拉格写信给卢瑟福,告诉他用 ![]() 粒子轰击原子时发生
粒子轰击原子时发生 ![]() 粒子急转弯的现象.这些现象促使他和盖革决定用重金属靶进行散射实验.1909年3月,卢瑟福向正在实验的马斯登提出“看一看你是否能够得到从金属表面直接反射
粒子急转弯的现象.这些现象促使他和盖革决定用重金属靶进行散射实验.1909年3月,卢瑟福向正在实验的马斯登提出“看一看你是否能够得到从金属表面直接反射
![]() 粒子的效应?”结果,马斯登发现了等于和大于90º的大角度散射现象.卢瑟福以特有的洞察力和直觉,抓住这个反常现象,从原子内存在强电场的思想出发,1911年构思出原子的核式结构模型.1912年,盖革和马斯登用实验证实了带正电的原子核的存在.1913年莫塞莱用元素特征谱线与原子序数的关系证实了核外电子环的存在.
粒子的效应?”结果,马斯登发现了等于和大于90º的大角度散射现象.卢瑟福以特有的洞察力和直觉,抓住这个反常现象,从原子内存在强电场的思想出发,1911年构思出原子的核式结构模型.1912年,盖革和马斯登用实验证实了带正电的原子核的存在.1913年莫塞莱用元素特征谱线与原子序数的关系证实了核外电子环的存在.
1918年,卢瑟福继J.J.汤姆孙之后,担任卡文迪什实验室领导,将卡文迪什实验室发展到一个新的高峰,将物质微观结构的研究推向崭新的阶段,同时也培养出了许多青年科学家.
卢瑟福是20世纪初最伟大的实验物理学家,他1908年获诺贝尔化学奖.一生发表论文约215篇,著作6种,培养了10位诺贝尔奖获得者.1937年10月19日他因患肠阻塞并发症逝世,葬于伦敦威斯敏斯特大教堂牛顿墓旁.
扩展资料
原子核与原子实
原子核与原子实是原子物理学中的两个基本概念,它们既有一定的联系又有一定的差别.为此,这里我们特把“原子实”概念作一系统介绍,旨在使有些读者能明晓原子实概念的全部内涵和外延,进而找出原子核与原子实的区别和联系.
原子核是原子的中心体,它的存在早在1911年为卢瑟福的![]() 粒子散射实验所证实.原子核由带正电的质子和中性的中子(统称孩子)组成,它们靠核力的作用结合在一起,一般成为一个稳定的结合体.
粒子散射实验所证实.原子核由带正电的质子和中性的中子(统称孩子)组成,它们靠核力的作用结合在一起,一般成为一个稳定的结合体.
原子核的形状接近于球形,通常以原子核的半径表示原子核的大小,其数量级为![]() 米,具体可按公式:
米,具体可按公式:
![]()
来计算.式中R为原子核的半径(核力作用半径),![]() 可近似地看作常数,测定值为
可近似地看作常数,测定值为![]() 米,A是所论原子核的质量数.
米,A是所论原子核的质量数.
自然界中存在的元素大多数具有稳定的原子核,但原子序数很高的重元素,其原子核很不稳定.另外,用高能粒子轰击稳定的原子核可产生人造原子核.现在已知的原子核已超过2500种,其中约有300种是稳定的,其余全不稳定.
根据“行星式原子模型”,任何元素的原子都是由一个原子核和核外按一定规律分布在一系列轨道上绕核运动的电子组成.那么,“原子实”到底是指什么呢?简言之,原子实就是指原子中除价电子外的其余部分.原子的价电子一般是指原子最外层能参加化学键的电子.
原子序数等于原子中的电子总数,现在可以列成如此整齐的形式决不是偶然的,这代表着原子中电子有规则的组合.在这些组合中有一个共同点,就是在一个完整的结构之外还多余一个电子.这个完整而稳固的结构称为原子实.如锂的原子实就由其原子核和核外两个电子构成,钠的原子实就由其原子核和核外10个电子构成,其余类推.
碱金属原子一切内层电子都沿着对称的轨道绕核运动,因而平均说来,可以认为它们的电荷均匀分布在以原子核为中心的一个或几个半径不同的球面上,负电荷中心重叠在原子中心(即正电荷中心),对于处在最外层的价电子来说,它们起着对原子核的正电荷屏蔽的作用.因此,我们可以近似地假定这Z-1个电子与原子核一起构成一个带有正电荷+e的“整体”.显然,对于这种情况,屏蔽常数![]() 就是Z-1,有效核电荷
就是Z-1,有效核电荷![]() ,而这里的所谓“整体”就是上述所定义的“原子实”,只不过是从电特性的等效角度看问题而已.由此可见,从电传性的等效角度看,“原子实”可等效于一个原子核,此原子核的核电荷就是有效核电荷
,而这里的所谓“整体”就是上述所定义的“原子实”,只不过是从电特性的等效角度看问题而已.由此可见,从电传性的等效角度看,“原子实”可等效于一个原子核,此原子核的核电荷就是有效核电荷![]() .式中屏蔽常数
.式中屏蔽常数![]() 的估计已由斯莱特(Slater,J·C,1900~)根据光谱数据归纳出一套方法.
的估计已由斯莱特(Slater,J·C,1900~)根据光谱数据归纳出一套方法.
概括起来说,原子核和原子实有以下几点联系和区别:
(1)原子核和原子实两者都包含正电荷且都是原子的组成部分,但原子核不包括负电荷而原子实一般包括负电荷,且负电荷数总是小于正电荷数.
(2)从电特性的等效角度看,原子实是一个等效的原子核,而真正的原子核又是一个特殊的原子实.譬如,氢原子的原子核对它的外层价电子来说,就是一个特殊的原子实(不包括负电荷).
(3)原子实由原子核和除掉某一最外层价电子外的其他核外电子组成,放它是一个介于原子核和原子之间的完整而稳固的结构整体.
(4)原子核具有衰变现象(包括人工的).另外,原子核还能产生裂变(重核)和聚变(轻核),从而获得巨大的原子能.原子实作为一个等效的原子核,具有一种特殊的现象——原子实的极化,原子实极化的强弱程度与原子实外的价电子轨道形成的形状和能量大小有关密切联系.
扩展资料
原子量的演变
自1803年道尔顿发表原子学说以来,人们自然就会提出“原子有多重?”等一系列问题.因为原子极小,故我们不能直接去称量一个原子的质量.但是,若能选定一种原子作为原子量的标准,而将其他原子的质量与选定为标准的原子的质量相比较,我们就可以得到相对原子量.相对原子量虽为一相对值,但同样也可以让我们知道各种原子的相对大小.那么,以哪种元素的原子量为标准呢?从相对取值的意义上说,可以取任一种元素原子的质量为相对标准.但因氢元素的原子是最轻的,若把最轻的氢原子取为一个最小的整数(此即道尔顿的标准)做为原子量的标准,则其他元素的原子量皆可以得到一个比1大的正值.
由于许多元素不和氢直接化合,若以氢为原子量标准,则常需用间接方法来求这个比值.当时已知大多数元素皆可以和氧化合,因此又选定氧等于16为标准(![]() 时,最轻的氢元素的原子量还是1,这是斯达的标准).
时,最轻的氢元素的原子量还是1,这是斯达的标准).
1826年贝采利乌斯曾以![]() 为标准.
为标准.
1860年又恢复为![]() 原子量标准,这是化学原子量标准.
原子量标准,这是化学原子量标准.
1929年发现氧有三种同位素![]() 、
、![]() 、
、![]() ,且这三种同位素在自然界中分布并不均匀,因此,以
,且这三种同位素在自然界中分布并不均匀,因此,以![]() 为标准就显得不十分恰当.于是,物理界就以天然的
为标准就显得不十分恰当.于是,物理界就以天然的![]() 做为物理原子量标准.这样,原子量就出现了两个标准,即化学标准与物理标准.
做为物理原子量标准.这样,原子量就出现了两个标准,即化学标准与物理标准.
1940年国际原子量委员会确定以1.000275作为两种标准的换算因子,即;
化学原子量=物理原子量/1.000275
原子量是一种重要的基本数据,物理界、化学界都希望有一个新的计量的统一标准,并要求改用新标准后,对现有原子量数值改变越小越好.1959年国际原子量委员会建议以![]() 为原子量标准,1960年国际物理学会,1961年国际化学学会先后都通过决定采用原子量新标准,至此,原子量有了新的统一标准.
为原子量标准,1960年国际物理学会,1961年国际化学学会先后都通过决定采用原子量新标准,至此,原子量有了新的统一标准.
为什么确定以![]() 为标准呢?这是因为:
为标准呢?这是因为:
(1)![]() 在碳的天然同位素中所含的丰度比较固定,不会因地而异;
在碳的天然同位素中所含的丰度比较固定,不会因地而异;
(2)对![]() 的质量测定比较精确;
的质量测定比较精确;
(3)以![]() 为标准后,各元素的原有原子量变化不大,仅比过去所用的原子量降低了0.0043%.
为标准后,各元素的原有原子量变化不大,仅比过去所用的原子量降低了0.0043%.
扩展资料
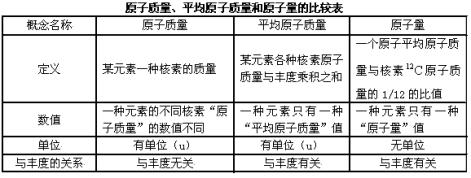
原子质量与原子量
原子质量与原子量既是化学中的概念又是原子物理学中的概念.这两个概念,也许是它们文字组成相似之故,所以,颇易引起混淆.原子量是原子质量概念发展起来的一个新概念,诚然,两者之间有密切联系,但是它们毕竟有着各自不同的内涵和外延,是两个可区分的概念.
1、原子质量
由于元素周期表中大多数元素几乎都具有不同数目的稳定同位素,每种核素的一个原子的质量称为该核素的原子质量.
原子质量单位定义为,一个原子质量单位等于一个处于基态的![]() 中性原子的静止质量的1/12.
中性原子的静止质量的1/12.
原子质量单位的符号为u,1u![]() 千克.
千克.
原子质量可用质谱仪直接测定.
2、原子量
国际原子量与同位素丰度委员会于1979年给原子量下的最新定义是:“一种元素的原子量是该元素1摩尔质量对核素![]() 的1摩尔质量的1/12的比值.”因为任何元素,其数量只要是1摩尔,它所含的原子个数就都相同(即等于阿佛加德罗常数).所以,上述定义又可表述为“一种元素的一个原子的平均质量对核素
的1摩尔质量的1/12的比值.”因为任何元素,其数量只要是1摩尔,它所含的原子个数就都相同(即等于阿佛加德罗常数).所以,上述定义又可表述为“一种元素的一个原子的平均质量对核素![]() 的一个原子质量的1/12的比值即为该种元素的原子量.”这里所谓的一个原子的平均质量,是对一种元素含着多种天然同位素说的,平均质量是根据这种元素的各种核素原子质量与丰度乘积之和而求得(元素的丰度是指化学元素在地球中的相对比率).
的一个原子质量的1/12的比值即为该种元素的原子量.”这里所谓的一个原子的平均质量,是对一种元素含着多种天然同位素说的,平均质量是根据这种元素的各种核素原子质量与丰度乘积之和而求得(元素的丰度是指化学元素在地球中的相对比率).
由此可见,原子量是一个比值,是一个无单位的纯数,是原子的平均相对质量.原子量常用符号Ar(E)表示,A代表原子量,r表示相对,E代表某元素.例如,氯元素在自然界中有两种同位素:核素![]() ,丰度为75.77%,原子质量为34.96885u;核素
,丰度为75.77%,原子质量为34.96885u;核素![]() ,丰度为24.23%,原子质量为36.96590u.
,丰度为24.23%,原子质量为36.96590u.
氯元素的平均原子质量![]()
于是,根据原子量的定义,氯元素的原子量为:

3、原子质量与原子量的区别
元素的“原子量”和核素的“原子质量”虽然都以![]() 为基准来描述原子的同一物理属性,但是,它们是两个不同的概念.现将它们的主要区别比较如下:
为基准来描述原子的同一物理属性,但是,它们是两个不同的概念.现将它们的主要区别比较如下:
(1)原子量是某元素一个原子的平均质量对![]() 核素一个原子的质量的1/12之比,而原子质量就是某核素一个原子的质量.前者是讨论某元素天然存在的所有核素原子的平均质量,后者只讨论某元素一种核素原子的质量.
核素一个原子的质量的1/12之比,而原子质量就是某核素一个原子的质量.前者是讨论某元素天然存在的所有核素原子的平均质量,后者只讨论某元素一种核素原子的质量.
(2)从数值上看,一种元素只有一个原子量数值,而大多数元素都有几种同位素,故大多数元素都有几种不同的原子质量数值.
(3)原子量没有单位,而原子质量有单位(u).因此,对单一核素元素而言,它的原子量和原子质量数值相等.但前者是无单位的而后者是有单位的.如钠元素的原子量等于22.98977,![]() 核素的原子质量等于22.98977u.
核素的原子质量等于22.98977u.
(4)原子量不但与原子本身的结构组成有关,而且还与各天然核素的相对丰度有关,而原子质量仅与该核素原子本身结构组成有关,与核素的丰度无关.
考虑到我们在引入原子量的概念时,不仅用了原子质量的概念,还用了平均原子质量的概念,所以,为了更便于比较这三个概念列表如下: