 设为首页
设为首页
 加入收藏
加入收藏
关于氢氧化钠和氧化物的教材分析
在讲氢氧化钠时,[实验8-23]的针对性很强,因为学生在前几章见过的氢氧化钠都是它的水溶液,学生可能误认为氢氧化钠是液态的,实验室里使用的氢氧化钠固体含有结晶水。由于此时学生尚未学习结晶水合物的概念,这里不宜引伸过多。
初中化学教材中对“氧化物”没单列一节来讲授。在讲酸的通性时,提到碱性氧化物,本节碱的通性里又提到酸性氧化物,教师可对无机物的分类进行小结,这样使同学的无机物分类知识较完整。
关于常见的碱 碱的通性的教材分析
本节教材分为四部分:一、氢氧化钠;二、氢氧化钙;三、碱的命名;四、碱的通性。其中有些内容学生并不陌生,如非金属氧化物与碱反应,学生学过二氧化碳与石灰水反应,但没见过氢氧化钠与非金属氧化物的反应。又如,在学习质量守恒定律时学生看到过氢氧化钠溶液与硫酸铜溶液的反应,那时观察目的主要集中在颜色状态改变后天平仍平衡,这说明发生化学变化前后质量上没有发生变化,但对氢氧化钠和硫酸铜这两种物质各有什么性质并未注意。本节课学习时则侧重于物质的性质上。这一节课里先后出现11个化学方程式,其中7个是学生以前没接触过的。因此教材仍按照从感性到理性,由个别到一般的认识原则编写。只是在碱的通性一段没有安排实验,只列出了四条性质,其原因是为了避免重复。
重点:氢氧化钠和氢氧化钙的化学性质及碱的通性。
难点:碱和非金属氧化物反应的化学方程式。
关于非金属氧化物和碱反应的化学方程式的教学建议
本节中写非金属氧化物和碱反应的化学方程式是个难点。这类反应难在不像复分解反应那样有规律地明显地交换成分。为此,可先写出非金属氧化物加水生成含氧酸的化学方程式,再以含氧酸和碱相互交换成分得出生成物。如二氧化硫和氢氧化钠反应,可写成如下化学方程式:
![]()
![]()
关于碱和碱的通性的教学建议
1.跟前面教几种常见的酸一样,一般应通过实物和实验现象的观察使学生得到鲜明的感性认识。同时要适当联系生产、生活实际,说明氢氧化钠、氢氧化钙的重要用途。讲用途应跟它们的性质联系起来。
2.在教氢氧化钠、氢氧化钙的性质时,如有条件,教材中的有关实验也可以采用“边讲边做实验”的方式进行。可以结合阅读课文引导学生正确描述实验现象和实验结论。
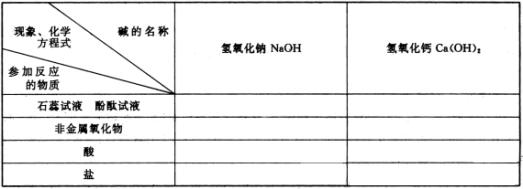
3.本节教材可用两课时完成,第一课时着重认识氢氧化钠、氢氧化钙的性质,第二课时介绍碱的命名和概括碱的通性。在分析碱跟盐的反应时,要求学生掌握可溶性碱跟可溶性盐反应生成另一种碱和另一种盐。为此,可以提前初步指导学生查阅酸、碱、盐的溶解性表。

注:第二、三、四、五项填写化学方程式,有“/”者不填。
4.酸和碱教完以后,可参考上表指导学生整理有关酸、碱的知识。
关于常见的碱 碱的通性的教学建议
由于本节教材中有些知识前面已经学过,又由于有了酸及其通性的教学模式,因此结合学生知识掌握情况,本节课可以采取两种不同的教法。
1、对于学生程度整齐,前面知识掌握牢固的班级,可以在教师引导下,通过回忆、整理,使分散的有关氢氧化钠和氢氧化钙的知识逐渐集中系统起来;也可根据已知的氢氧化钙的化学性质,推测氢氧化钠的性质。为此可按下表所列项目,由学生回忆,把学过的知识填在表里,然后把没填写的部分,结合演示实验或学生实验—一填充。例如,学生可以回忆起氢氧化钙与二氧化碳反应,而不知二氧化碳和氢氧化钠反应。可增做二氧化碳与氢氧化钠溶液反应的实验,其装置如图,在大烧瓶里收满二氧化碳,烧瓶用带导管的胶塞塞紧,伸入烧瓶的导管一端,事先绑好一个气球。当拔开胶塞倒入浓氢氧化钠溶液后,立即塞紧,振荡,可以看到气球逐渐膨大。经讨论后可写出反应的化学方程式:
![]()
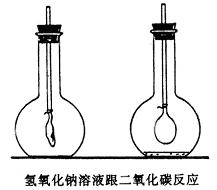
当表格中的化学性质—一填充后,教师应予以总结,使学生从对具体物质的认识上升到对碱这一类物质的认识。
按以上的设想,本节课的讲授顺序可采取先做[实验8-23]和[实验8-25],弄清氢氧化钠和氢氧化钙的物理性质,再讲化学性质,结合化学性质讲用途,最后是命名和通性。
2、对于学生程度不齐,前面所学知识尚不熟悉、巩固的班级,还是以采用第三节常见的酸的教学模式为妥。按照教材的安排,先讲氢氧化钠,再讲氢氧化钙。若采取上述氢氧化钙和氢氧化钠一起对比讨论的方法,这些同学可能会反应“混乱”。
关于盐和碱反应的教学建议
盐和碱的反应必须是可溶性减和可溶性盐反应生成沉淀才能发生。由于学生还没学习盐的性质,他们可能套用“盐跟碱起反应,产生另一种盐和另一种碱”的结论,而写出如下的不存在的化学方程式:
![]()
对待这个问题,建议针对具体情况,采取以下两种方法来解决。一是对照课本后边的溶解性表,讲一点盐和碱的溶解性知识,指出盐和碱的反应是有条件的,两者都必须溶于水,在水溶液里进行。或是明确提出在目前阶段只要求学生掌握教材里给定反应的化学方程式。
演示实验建议
1.[实验8-24]氢氧化钠溶液跟硫酸铜、氯化铁溶液反应时,所用溶液的浓度都以0.5摩/升为宜。配制0.5摩/升氯化铁溶液可以称取六水合氯化铁( ![]() )13.5克,先溶于少量蒸馏水中(加几滴盐酸),然后再加蒸馏水稀释至 100毫升即可。
)13.5克,先溶于少量蒸馏水中(加几滴盐酸),然后再加蒸馏水稀释至 100毫升即可。
2.石灰水的制备 石灰水是化学实验中常用的试剂,由于石灰水的浓度小(常温下饱和石灰水的浓度为0.02摩/升),且容易吸收空气中的二氧化碳生成碳酸钙。用下述方法可制得能长期使用的石灰水。
选新烧制的生石灰,洒少量水熟化,全部粉碎后,把它放入大口试剂瓶中,约半瓶。加满水并搅拌后,用胶塞塞紧,静置后分层。上层即澄清的饱和石灰水,使用时,轻轻地倾斜瓶口,倒出澄清石灰水,随之补充水搅拌后,盖上胶塞备用。
3.[实验8-28]氢氧化钙与碳酸钠溶液反应,要用浓碳酸钠溶液,最好用饱和碳酸钠溶液。因为氢氧化钙在水中的溶解度小,溶液的浓度低,如用稀碳酸钠溶液,生成的白色沉淀量很少,现象不明显。