 设为首页
设为首页
 加入收藏
加入收藏
扩展资料
关于“化学平衡的移动”
化学平衡的移动是由于浓度、温度、压强的变化,使 ![]() 。当
。当 ![]() 时,平衡向正反应方向移动;当
时,平衡向正反应方向移动;当 ![]() 时,平衡向逆反应方向移动。
时,平衡向逆反应方向移动。
(1)浓度对平衡移动的影响
我们仍以二氧化硫氧化为三氧化硫为例:
![]()
![]()
![]()
分析浓度变化对平衡移动的影响。
在平衡体系中, ![]() ,平衡混合物里各组份百分含量保持一定。
,平衡混合物里各组份百分含量保持一定。
当增大反应物浓度时,新的正反应速率 ![]() 增大,即
增大,即 ![]() ,由于生成物的浓度没有变化,在
,由于生成物的浓度没有变化,在 ![]() 增大的瞬间,
增大的瞬间, ![]() 并没有增加,即
并没有增加,即 ![]() 。所以,此时
。所以,此时 ![]() ,平衡将向正反应方向移动。
,平衡将向正反应方向移动。
随着时间的推移,反应物浓度下降, ![]() 要逐渐下降;生成物
要逐渐下降;生成物 ![]() 增加,
增加, ![]() 要逐渐上升。
要逐渐上升。
当达到 ![]() 时,
时, ![]() ,又建立起新的平衡。这种旧平衡的破坏,新平衡形成的过程,叫做化学平衡的移动。新平衡混合物里各组分百分含量与旧平衡混合物各组分百分含量已经发生了变化。增大反应物浓度对化学平衡移动的影响,可以用下图表示。
,又建立起新的平衡。这种旧平衡的破坏,新平衡形成的过程,叫做化学平衡的移动。新平衡混合物里各组分百分含量与旧平衡混合物各组分百分含量已经发生了变化。增大反应物浓度对化学平衡移动的影响,可以用下图表示。
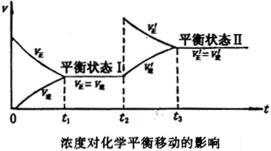
(2)压强对平衡运动的影响
学习压强对平衡移动影响的时候,要注意的一点是,当增大平衡体系压强,混合物由各气体组分的浓度以同等倍数增加,但是,这种气体物质浓度的等倍数增加,不见得会使正、逆反应速率等倍增加。例如
![]()
![]()
![]()
当反应处于化学平衡状态时, ![]() ;如果此时把压强增大一倍,则
;如果此时把压强增大一倍,则 ![]() 均为原平衡浓度的两倍,这种浓度的变化对正逆反应速率的影响是:
均为原平衡浓度的两倍,这种浓度的变化对正逆反应速率的影响是:
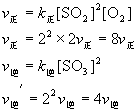
这就是说当把压强增大一倍时,虽然正、逆反应速率都增加了,正反应速率是原平衡速率的8倍,逆反应速率是原平衡速率的4倍。
![]()
所以,增加压强会使平衡向生成三氯化硫的方向移动,也就是向气体体积缩小的方向移动。
又如下述平衡体系:
![]()
![]()
![]()
1体积 2体积
![]() 是1体积,
是1体积, ![]() 是2体积,当增加压强时,逆反应速率增加的多,使
是2体积,当增加压强时,逆反应速率增加的多,使 ![]() ,平衡向逆反应方向移动。
,平衡向逆反应方向移动。
反应物与生成物的气体分子数相等,即气体体积相等的反应如:
![]()
![]()
![]()
压强变化,并不能使平衡发生移动。
压强对化学平衡的影响可以总结如下:在温度一定的条件下,增大压强,使平衡向气体体积缩小的方向移动;减小压强,使平衡向气体体积增大的方向移动;如果反应物与生成物的气体分子数相等时,改变压强平衡不移动;平衡混合物各组分均为液相或固相时,改变压强平衡也不移动
(3)温度对平衡移动的影响
温度对平衡移动的影响,取决于化学反应的热效应。对于正反应方向是放热的平衡体系,升高温度,平衡向逆反应方向移动;正反应方向是吸热的平衡体系,升高温度,平衡向正反应方向移动。例如:
![]()
![]()
![]()
(红棕色) (无色)
升高温度,红棕色变深,说明平衡向逆反应方向移动;降低温度,红棕色变浅,说明平衡向正反应方向移动。
浓度,压强,温度对化学平衡的影响,可以概括为平衡移动原理——勒沙特列原理:如果改变影响平衡的一个条件,平衡就向能够减弱这种改变的方向移动(催化剂能等倍地增加正,逆反应的速率,不能造成平衡的移动。)
扩展资料
学习本节应注意的问题:
(1)不要把反应速率,化学平衡混同起来。化学反应速率研究化学反应进行的快慢,化学平衡研究可逆反应完成的程度。计算反应速率的关键在于找出转化浓度,有关化学平衡的计算关键在于根据起始浓度,平衡浓度之差确定转化浓度及转化率。
(2)不要把正反应速率( ![]() )的增加,同平衡向正反应方向移动等同起来。例如,合成氨反应,升温虽然使
)的增加,同平衡向正反应方向移动等同起来。例如,合成氨反应,升温虽然使 ![]() 加快,但
加快,但 ![]() 加快更多,平衡向逆反应方向移动。学习中一定要明确
加快更多,平衡向逆反应方向移动。学习中一定要明确 ![]() ,才是平衡向正反应方向移动的唯一依据。
,才是平衡向正反应方向移动的唯一依据。
(3)不要把化学平衡向正反应方向移动同原料转化率的提高等同起来。例如二氧化硫催化氧化反应
![]()
当增大 ![]() 时,平衡会向正反应方向移动。但
时,平衡会向正反应方向移动。但 ![]() 的转化率反而下降,另一种反应物
的转化率反而下降,另一种反应物 ![]() 的转化率提高。
的转化率提高。
(4)不要把温度对化学反应速率和化学平衡的影响混同起来。
![]()
![]()
![]()
平衡体系中,升高温度,化学平衡向逆反应方向移动。有的同学错误地认为升温使 ![]() 减小,使
减小,使 ![]() 增大,实际是升温使
增大,实际是升温使 ![]() 、
、 ![]() 同时增大,不过
同时增大,不过 ![]() 增快的更多。正确的认识是:升高温度,可使任何化学反应的反应速率加快;升温,对平衡移动方向的影响,取决于这个化学以应的热效应。
增快的更多。正确的认识是:升高温度,可使任何化学反应的反应速率加快;升温,对平衡移动方向的影响,取决于这个化学以应的热效应。
扩展资料
掌握化学平衡的正确概念
化学平衡的概念比较抽象,学习起来有一定难度,死记硬背定义,不是好的学习方法。正确的学习方法是:
(1)从具体到抽象
分析可逆反应
![]()
![]()
![]()
随着 ![]() 与
与 ![]() 化合为
化合为 ![]() 反应的进行,各物质的物质的量浓度的变化,以及
反应的进行,各物质的物质的量浓度的变化,以及 ![]() ,
, ![]() 的变化如下:
的变化如下:
反应开始时
![]() 最高
最高 ![]() 最大
最大
![]()
![]()
反应进行中
![]() 逐渐下降
逐渐下降 ![]() 最大
最大
![]() = 0逐渐升高
= 0逐渐升高 ![]() 逐渐增大
逐渐增大
到达 ![]() 时
时
![]()
![]() 不变
不变 ![]()
在可逆反应中,正、逆反应速率随时间的变化,可以用下图表示。
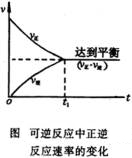
当 ![]() 时,
时, ![]() 跟
跟 ![]() 生成
生成 ![]() 的速率与
的速率与 ![]() 分解为
分解为 ![]() ,
, ![]() 的速率相等,所以此时反应混合物里各组分的百分含量保持不变的状态。
的速率相等,所以此时反应混合物里各组分的百分含量保持不变的状态。
(2)透过现象,抓住本质
达到平衡状态以后,在条件不变时,无论延长多少时间,反应混合物的百分组成都不会发生变化,似乎这个反应已经停止,这是个表面现象。学习时,一定要透过现象抓住实质,明确化学平衡是一种动态平衡,即达到平衡时正,逆反应仍在继续进行,只不过两者的速率相等。
![]()
才是化学平衡的本质。
当浓度、压强、温度等外界条件改变时,使正反应速率与逆反应速率不相等,原有的化学平衡状态受到破坏,平衡发生移动,经过一段时间后,又会在新的条件下达到新的平衡。
学习化学平衡概念,一定要明确它研究对象是“一定条件下的可逆反应”,它的本质特征是“正反应速率和逆反应速率相等”以及这个本质特征决定的“平衡混合物中的各组分百分组成一定,深刻理解动态平衡的含义。化学平衡特征可以用“动”、“定”、“变”三字概括。