设为首页
设为首页
 加入收藏
加入收藏
教学设计示例(一)
第一课时
按照自学提纲阅读教材,对金属的通性、镁和铝的性质进行归纳比较,并思考问题,使自己基本掌握课本的主要内容(填写有关空白)。
第一节 镁和铝(自学提纲)
金属的分类及依据
1.冶金工业:分为 金属(只有 、 、 三种);其余为 金属。(注:实际上,黑色金属并不黑,铁、铬、锰均为光亮的银白色金属。)
2.根据密度不同:分为
金属,密度小于
![]() ,如: 、
、 、
、
; 金属;密度大于
,如: 、
、 、
、
; 金属;密度大于
![]() ,如 、
、 。
,如 、
、 。
3.根据地壳中的含量:分为 金属,如 、 、 、 ; 金属,如 、 、 。
练习:按上述分类原则,铁属于 ,钠属于 。
A.银白色金属 B.黑色金属 C.重金属 D.轻金属 E.常见金属
金属的通性
1.金属的物理性质
主要有 、 、 、 、 、 。
2.金属的化学性质
金属容易 电子,变成 ,表现出 ,是常见的 剂。不同的金属 性强弱不同,在初中化学教材中学习过的用来描述这一规律的“表”称为 表,具体内容为 。
镁和铝的性质
(一)镁和铝的原子结构及物理性质
1.镁的原子结构简图为 ,电子式是 ,在元素周期表中的位置: 周期, 族。铝的原子结构简图为 ,电子式: ,在元素周期表中的位置: 周期, 族。镁的原子半径 (填大于、小于或不能确定)铝的原子半径。
2.分析镁、铝物理性质的相似性、差异性,并运用学过的知识进行解释。
(二)镁、铝的化学性质(前一部分)
1.与非金属单质反应(写出镁、铝分别与
![]() 反应的化学方程式及现象) 。
反应的化学方程式及现象) 。
2.与水反应(若能反应请写出化学方程式) 。
3.与酸反应
(1)写出镁、铝与盐酸反应的离子方程式: , 。
(2)分析镁、铝与浓、稀硝酸,浓、稀硫酸反应的情形。
教师讲解
金属的分类
按照不同的分类标准,可对金属从不同的角度进行分类。
1.冶金工业的分类方法
黑色金属:铁、铬、锰(注意:实际上,铁、铬、锰均为银白色金属)
有色金属:除上述三种以外的其他金属,如常见的铝、镁等。
2.根据金属密度的大小
轻金属:密度小于
![]() 的金属。如铝、钠、钾、镁、铝等。
的金属。如铝、钠、钾、镁、铝等。
重金属:密度大于
![]() 的金属。如铁、铜、银、汞等。
的金属。如铁、铜、银、汞等。
3.根据地壳中的含量
常见金属:如铁、铜、锡、镁、铝等
稀有金属:如铜、锆、铌等。
金属的通性
1.物理性质(可以展示几种金属样品,让学生通过观察、讨论得出)
(1)常温时,除了汞为液体外,其他金属都是固体。
(2)有金属光泽。这种现象只有当金属为块状时才能表现出来,粉末状时呈暗灰色或黑色。
(3)大多数金属有良好的导电性和导热性,导电性最好的是Ag,其次是Cu,再后为Al。
(4)大多具有展性和延性。延性最好的是铂,展性最好的是金。
(5)金属的硬度一般较大。但不同金属差别也大,最硬的是铬。而Na、K很软。
(6)金属的熔点一般较高。但高低差别较大,最难熔的是钨,最易熔的是汞。
2.化学性质(可以先让学生回忆学过的一些金属的化学性质,然后归纳)
金属容易失去最外层电子,变成金属阳离子,表现出还原性。
金属还原性强弱顺序可归纳为(金属活动顺序表):K Ca Na Mg Al Zn Fe Sn Pb(H)Cu Hg Ag Pt
(1)排在前面的金属能把后面的金属从其盐溶液中置换出来;
(2)排在氢前面的金属能从烯酸溶液中置换出氢。
镁、铝的性质
(1)镁、铝的原子结构和物理性质
1.原子结构
(1)原子结构示意图
(2)电子式
(3)周期表中的位置
(4)原子半径: ![]()
2.物理性质
(1)相似性:都是银白色的轻金属,有较强的韧性、延性和展性,熔点较低,硬度较小,有良好的导电、导热性。
(2)差异性:铝的硬度比镁大,熔点、沸点比镁高。
原因:铝的价电子比镁多,原子半径比镁小,故铝单质中所存在的化学键比镁中的强。
镁、铝的化学性质
1.与非金属反应
(教师演示镁条在空气中燃烧的实验,引导学生观察现象,并要求写出化学方程式)。
![]() (现象:镁条燃烧,发出耀眼的白光)
(现象:镁条燃烧,发出耀眼的白光)
铝箔在氧气中可以燃烧,并放出大量的热,产生耀眼的白光。
![]()
![]()
![]()
注:常温下,在空气中镁、铝的表面均能形成氧化薄膜而失去金属光泽,由于氧化膜能阻止金属继续氧化,所以镁和铝都有抗腐蚀性。
练习写出镁、铝分别与氯气、硫、氮气反应的化学方程式。
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
2.与水反应
先去掉镁、铝表面的氧化膜:镁用砂纸擦亮;铝需用
![]() 溶液处理。
溶液处理。
(补充实验:镁和水反应,引导学生观实现象并写出化学方程式)
3.与酸溶液反应
让学生演示实验:镁、铝与盐酸、稀硫酸反应;镁、铝与浓
![]() 、浓
、浓 ![]() 反应。引导同学们观察现象并写出反应的离子方程式。
反应。引导同学们观察现象并写出反应的离子方程式。
(1)与非氧化性酸反应
![]()
![]()
(2)与氧化性酸反应
![]()
![]()
铝被冷的浓 ![]() 或浓
或浓 ![]() 所钝化。因此常用铝桶装运浓
所钝化。因此常用铝桶装运浓 ![]() 、浓
、浓 ![]() 。
。
随堂练习
1.下列叙述中所描述的物质一定是金属元素的是( )
A.易失去电子的物质
B.原子最外层只有一个电子的元素
C.单质具有金属光泽的元素
D.第三周期中,原子的最外层上只有2个电子的元素
2.相同质量的镁和铝分别跟足量的盐酸溶液反应,生成氢气的体积比为( )
A.1:1 B.1:2 C.2:3 D.3:4
3.由钠、镁、铝、锌四种金属单质中的两种组成的合金12g,跟足量的盐酸反应,产生5.6L标准状况下的氢气,那么此合金中一定含有的金属是( )
A.Na B.Mg C.Al D.Zn
板书设计
第一课时
第四章 几种重要的金属
第一节 镁和铝
一、金属的分类
1.冶金工业
黑色金属:铁、铬、锰
有色金属:除上述三种外
2.根据密度
重金属: ![]()
轻金属: ![]()
3.据地壳中的含量
常见金属:铁、铝、铜
稀有金属:钽、锆、铌
二、金属的通性
1.物理性质:固态(除Hg外);金属光泽;导电导热;延展性;较大的硬度;较高的熔沸点。
2.化学性质:
(1)易失电子,表现出还原性,作还原剂。
(2)金属活动顺序表:
K Ca Na Mg Al Zn Fe Sn Pb(H) Cu Hg Ag Pt Au
三、镁、铝的性质
(一)镁、铝的原子结构和物理性质
1.原子结构
(1)原子结构示意图:
(2)电子式;
(3)周期表中的位置;
(4)原子半径;
2.物理性质
(1)相似性;
(2)差异性;
(二)镁、铝的化学性质
1.与非金属反应
![]() ,镁条在空气中燃烧,发出耀眼的白光。
,镁条在空气中燃烧,发出耀眼的白光。
![]() 。
。
注:(1)镁、铝在空气中表面形成了一层致密的氧化膜。(2)镁、铝的性质较活动,与许多其他的非金属(如 ![]() 等)可反应。
等)可反应。
2.与水反应:先去膜—Mg:用砂纸;Al:用 ![]() 溶液。
溶液。
![]()
![]()
![]()
![]()
3.与酸反应
(1)非氧化性酸(盐酸、稀 ![]() 等)
等)
![]()
![]()
(2)与氧化性酸(浓 ![]() 、硝酸等)
、硝酸等)
Mg可以反应,但没有
![]() 产生。
产生。
Al遇浓 ![]() 、浓
、浓 ![]() 纯化
纯化
第二课时
(一)教学目标
1.掌握铝与碱反应的化学方程式并理解其反应实质。
2.掌握镁、铝与氧化物的反应。
3. ![]() 的两性。
的两性。
(二)教学过程
1.铝与强碱溶液的反应
由学生演示实验,观察现象并思考如何进行解释,写出反应方程式,并标出电子转移的方向和数目。
Mg与碱溶液不反应,Al可以与强碱溶液反应,并产生可燃性的气体(
![]() ),反应方程式为:
),反应方程式为:
![]()
说明点:(1)铝的表面有一层氧化膜(氧化铝),能与氢氧化钠反应而除去,从而使铝暴露出来与水反应生成氢氧化铝,而氢氧化铝具有两性,与碱反应生成盐和水,而使反应得以进行。所以事实上该反应是分两步进行的:
![]()
![]()
总反应为:
![]()
(2)铝与氢氧化钠溶液反应时,氧化剂是水。
练习:回忆硅与氢氧化钠溶液的反应,写出反应方程式:
![]()
注:在这个反应中氧化剂也是
![]() ,所以若要标出电子转移的数目需要在方程式的两边各补上2个
,所以若要标出电子转移的数目需要在方程式的两边各补上2个
![]() 分子。
分子。
2.与某些氧化物反应
(1)镁与二氧化碳的反应
演示镁条在二氧化碳中燃烧的实验,观察现象然后由学生分析出化学方程式。
![]()
![]()
![]()
说明:
a.现象:剧烈燃烧,生成白色固体,在集气瓶壁上有黑色固体生成。
b.该反应为置换反应,说明了镁的强还原性。
c.该反应同时也说明 ![]() 不支持燃烧是相对的。
不支持燃烧是相对的。
思考题:镁在二氧化硫中能否燃烧?
镁在二氧化硫中燃烧与在二氧化碳中相似,生成氧化镁和单质硫,但是生成的硫能继续与镁反应,生成硫化镁。
![]()
![]()
![]() ,
, ![]()
(2)铝热反应
演示铝热反应,由学生写出反应方程式,分析各种试剂的作用。
![]()
![]()
![]()
说明:
a.在该反应中,镁条和氯酸钾是引燃剂,镁条在空气中可以燃烧,氧气是氧化剂。但插入混合物中的部分镁条燃烧时,氯酸钾则是氧化剂,以保证镁条的继续燃烧,同时放出足够的热量引发氧化铁和铝粉的反应。由于该反应放出大量的热,只要反应已经引发,就可剧烈进行,放出的热使生成的铁熔化为液态。
b.铝热剂:铝粉和某些金属氧化物(氧化铁、氧化亚铁、四氧化三铁、五氧化二钒、三氧化二铬、二氧化锰等)组成的混合物
c.应用:
①野外焊接
②冶炼难熔金属
![]()
![]()
![]()
铝的重要化合物
1.镁铝在自然界中的存在
(1)镁:占地壳总质量的2.0%,在所有元素中为第8位,主要存在形式有:光卤石(
![]() )、白云石(
)、白云石( ![]() )、菱镁矿(
)、菱镁矿( ![]() )、硫酸镁、滑石、石棉等。
)、硫酸镁、滑石、石棉等。
(2)铝:占地壳总质量的7.7%,在所有元素中是第3位,在金属中为第1位,主要存在形式有:铝土矿(
![]() )、明矾石(
)、明矾石( ![]() )、长石、云母等。
)、长石、云母等。
镁和铝在自然界中只有化合态。
2.氧化铝
![]() 为白色粉末,不溶于水,熔点2050℃,用作耐火材料。自然界中纯净的
为白色粉末,不溶于水,熔点2050℃,用作耐火材料。自然界中纯净的
![]() 为无色晶体,俗称刚玉,硬度仅次于金刚石。
为无色晶体,俗称刚玉,硬度仅次于金刚石。
![]() 具有两性,既可与酸反应,又可与碱反应。
具有两性,既可与酸反应,又可与碱反应。
![]()
![]()
(三)随堂练习
1.工业上冶炼钒、铬等难熔金属,常用的还原剂是( )
A.氢气 B.金属钠 C.铝 D.一氧化碳
2.有一不纯的铝中含有硅和铁两种杂质。取两份等质量的样品,分别与足量的盐酸和氢氧化钠溶液充分反应后,生成等量的气体,则不纯铝中含铁和硅的比是( )
A.质量之比为2:1 B.物质的量之比为1:1
C.质量之比为1:1 D.物质的量之比为2:1
3.将相同质量的镁条分别在①氧气中②空气中③氮气中④二氧化碳中燃烧,燃烧后所得固体产物的质量由小到大的排列顺序为 (填序号)
板书设计
4.铝与强碱溶液反应
![]()
注:(1)理解: ![]() 先与
先与 ![]() 反应,生成的
反应,生成的 ![]() 可溶解于
可溶解于 ![]() 溶液中,促进反应进一步进行。
溶液中,促进反应进一步进行。
(2)氧化剂是 ![]() ;本质为:
;本质为:
![]()
练习: ![]()
5.与某些氧化物反应
![]()
![]()
![]() (剧烈燃烧,耀眼白光,生成白色、黑色两种固体。)
(剧烈燃烧,耀眼白光,生成白色、黑色两种固体。)
![]()
![]()
![]() (铝热反应)
(铝热反应)
四、铝的重要化合物
1.镁、铝的存在:在自然界中仅有化合态。其中镁主要以
![]() 等形式存在;铝主要以
等形式存在;铝主要以 ![]() 等形式存在,其在地壳中的含量居第3位(金属中第1)。
等形式存在,其在地壳中的含量居第3位(金属中第1)。
2.氧化铝
物理性质:白色难熔的粉末状固体,不溶于水,是一种耐火材料。
化学性质:两性氧化物(既可与酸反应,又可与碱反应)
![]()
![]()
教学设计示例(三)
第三课时
(一)教学目标
1.理解氢氧化铝的两性。
2.了解复盐及明矾的成分、物理性质、用途。
3.掌握并理解有关计算和图像。
(二)教学过程
1.氢氧化铝—典型的两性氢化物
演示教材[实验4-5.4-6],引导学生观察现象并书写离子反应方程式。
![]()
![]()
![]()
![]()
![]()
![]()
说明:氢氧化铝在水溶液中有两种电离方式:
![]()
![]()
![]()
![]()
![]()
酸式电离 碱式电离
当向 ![]() 溶液中加酸时,抑制酸式电离,促进碱式电离。若加入足量的酸,则
溶液中加酸时,抑制酸式电离,促进碱式电离。若加入足量的酸,则
![]() 将完全以碱的形式电离,即
将完全以碱的形式电离,即 ![]() 溶于酸中;当向
溶于酸中;当向 ![]() 溶液中加碱时,抑制碱式电离,促进酸式电离。若加以足量的碱,则
溶液中加碱时,抑制碱式电离,促进酸式电离。若加以足量的碱,则
![]() 完全以酸的形式电离,即
完全以酸的形式电离,即 ![]() 溶于碱中。
溶于碱中。
注:氢氧化铝不能与弱酸反应,如向氢氧化铝浊液中通入二氧化碳不溶解;也不与弱碱反应如氨水。故实验室用
![]() 制
制 ![]() ,而不用强碱。
,而不用强碱。
4.硫酸铝钾
俗名:明矾(晶体)
化学式: ![]() 或
或 ![]()
电离方程式: ![]()
物理性质与用途:无色晶体,易溶于水(溶于水时,因水解而显酸性)。
常作净水剂(原理: ![]()
![]()
![]() )
)
胶状
合金
1.定义—由两种或两种以上的金属(或金属与非金属)熔合在一起形成的具有金属特性的物质。合金属于混合物,如:黄铜、青铜、钢、生铁、钠钾合金等。
2.合金的性质特点
一般说来,合金的熔点比其成分金属都低,而在硬度、韧性等方面却往往有其他成分金属所不具有的独特的性质。如:纯铁的硬度很小而刚的硬度较大。
3.镁铝的合金简介
镁和铝的合金主要以质轻为特点,用于航空航天事业等。目前通常用的铝合金门窗的成分是硬铝。
“铝三角”及相应的图像
(以下均可采取学生分组实验的方式,由学生观察现象得出结论并分析出反应方程式,然后在老师的指导下画出相应图像)
1.向一定量 ![]() 溶液中逐滴加入
溶液中逐滴加入 ![]() 溶液
溶液
![]()
![]()
先生成白色沉淀,然后白色沉淀溶解
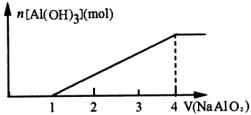
2.向一定量 ![]() 溶液中逐滴加入
溶液中逐滴加入 ![]() 溶液
溶液
![]()
![]()
开始生成的白色沉淀振蒎后消失,随后生成的白色沉淀不溶解。

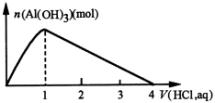
3.向一定量 ![]() 溶液中逐滴加入
溶液中逐滴加入 ![]() 溶液
溶液
![]()
![]()
先生成白色沉淀,然后白色沉淀逐渐溶解。
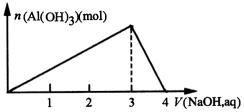
4.向一定量 ![]() 溶液中逐滴加入
溶液中逐滴加入 ![]() 溶液
溶液
![]()
![]()
开始生成的白色沉淀振荡后消失,随后生成的白色沉淀不溶解。

(三)随堂练习
1.实验室中,要使 ![]() 溶液中的
溶液中的 ![]() 离子全部沉淀出来,适宜用的试剂是(
)
离子全部沉淀出来,适宜用的试剂是(
)
A. ![]() 溶液 B.
溶液 B.
![]() 溶液 C.盐酸
D.氨水
溶液 C.盐酸
D.氨水
2.有200mL、 ![]() 和
和 ![]() 的混合溶液,其中
的混合溶液,其中 ![]() 为0.2mol/L,
为0.2mol/L, ![]() 为1.3mol/L。要使
为1.3mol/L。要使 ![]() 离子转化为沉淀从溶液中分离出来,至少需要加4mol/L,
离子转化为沉淀从溶液中分离出来,至少需要加4mol/L,
![]() 溶液的体积为( )
溶液的体积为( )
A.40mL B.72mL C.80mL D.128mL
3.在 ![]() 溶液中,加入含
溶液中,加入含 ![]() 的溶液,则下列对于Al元素的存在情况,叙述不正确的是(
)
的溶液,则下列对于Al元素的存在情况,叙述不正确的是(
)
A.若 ![]() ,铝元素全部以
,铝元素全部以 ![]() 形式存在
形式存在
B.若 ![]() ,铝元素全部以
,铝元素全部以 ![]() 形式存在
形式存在
C.若 ![]() ,铝元素以
,铝元素以 ![]() 和
和 ![]() 形式存在
形式存在
D.若 ![]() ,铝元素以
,铝元素以 ![]() 和
和 ![]() 形式存在
形式存在
4.把由 ![]() 三种固体组成的混合物溶于足量水中,有0.58g白色难溶物析出,向所得的溶液中逐滴加入0.5mol/L的盐酸,加入盐酸的体积和生成沉淀的质量如图所示:
三种固体组成的混合物溶于足量水中,有0.58g白色难溶物析出,向所得的溶液中逐滴加入0.5mol/L的盐酸,加入盐酸的体积和生成沉淀的质量如图所示:
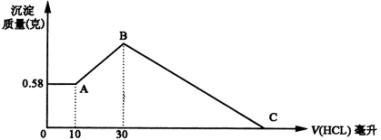
(1)混合物中 ![]() 的质量是
克;
的质量是
克; ![]() 的质量是
克;
的质量是
克; ![]() 的质量是
克。
的质量是
克。
(2)C点所表示盐酸加入的体积为 毫升。
(四)总结、延伸
偏铝酸钠是一种弱酸盐,可以与强酸反应,生成弱酸(氢氧化铝),如:
1.与盐酸反应: ![]()
![]()
2.与二氧化碳反应:
![]()
![]()
板书设计
3.氢氧化铝—典型的两性氢氧化物。
![]()
![]()
注:①氢氧化铝不能与弱酸、弱碱反应。
②实验室用 ![]() 来制取
来制取 ![]()
③ ![]() 呈现两性的原因:
呈现两性的原因:
![]()
![]()
![]()
![]()
![]()
4.硫酸铝钾
![]()
十二水合硫酸铝钾[ ![]() ]俗称明矾。明矾是无色晶体,易溶于水,发生水解产生絮状
]俗称明矾。明矾是无色晶体,易溶于水,发生水解产生絮状
![]() ,吸附能力很强,能吸附水里的杂质,并形成沉淀,使水澄清,所以明矾常作净水剂。
,吸附能力很强,能吸附水里的杂质,并形成沉淀,使水澄清,所以明矾常作净水剂。
五、合金
1.定义:由两种或两种以上金属(或金属与非金属)熔合在一起形成的具有金属特性的物质。合金属于混合物。
2.合金的性质特点:一般说来,合金的熔点比其成分金属都低,而在硬度、韧性等方面却往往有其他成分金属所不具有的独特的性质
六、“铝三角”及相应的图像
![]() 之间的转化
之间的转化
1.向一定量 ![]() 溶液中滴加
溶液中滴加 ![]() 溶液。
溶液。
![]()
![]()

2.向一定量氢氧化钠溶液中滴加
![]() 溶液
溶液
![]()
![]()

3.向一定量 ![]() 溶液滴加盐酸溶液
溶液滴加盐酸溶液
![]()
![]()

4.向一定量 ![]() 溶液中逐滴加入
溶液中逐滴加入 ![]() 溶液
溶液
![]()
![]()