 设为首页
设为首页
 加入收藏
加入收藏
教学重点:原子概念的形成及原子和分子的本质区别
教学难点:原子概念的形成、化学反应的实质
教学过程
第一课时
1.复习旧知识 投影:用分子的观点解释下列两个变化
1)液态水受热变为水蒸气
2)硫燃烧生成二氧化硫
2.问题引入:物质发生化学变化时有新分子产生,那么分子在化学变化中是如何改变的?又如何由原来的分子转变成新分子呢?
3.演示实验:氧化汞受热分解的实验
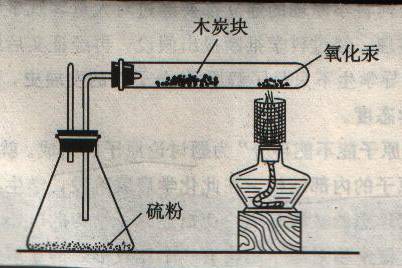
提出观察要求:
1)先给木炭加热,观察木炭有什么变化
2)再同时给氧化汞加热观察:
a.试管壁上有什么变化
b.木炭是否燃烧
说明:锥形瓶中的药品是硫粉,硫粉是用来处理实验中的有毒物质
学生观察并描述实验现象 ( 先给木炭加热,木炭不能燃烧;同时给氧化汞加热试管壁上有银白色小液滴,木炭燃烧。)
4.讲述:试管壁上的银白色小液滴是金属汞,在常温下汞是金属中唯一的一种液体物质
5.思考:木炭为什么能燃烧?指导学生写出氧化汞受热反应的文字表达式,(一名学生板演) 判断反应类型
6.设疑:从宏观上我们已经得到结论,加热氧化汞能生成汞和氧气,那么这个反应在微观上是怎么变化的呢?(引发学生想弄清氧化汞受热生成汞和氧气微观过程的欲望)
7.多媒体展示:氧化汞受热分解反应的微观示意图 (一)

对照画面讲解氧化汞及氧化汞分子的构成 (氧化汞是由氧化汞分子构成的,一个氧化汞分子是由一个氧粒子和一个汞粒子构成的)
8.学生讨论:氧化汞受热从微观上是怎么变化的?结合多媒体展示的画面(二)(三)
9.汇报与交流:每组派代表发言。通过小组的分析、讲解、补充和纠正得出:氧化汞受热后结合在一起的氧粒子、汞粒子彼此分开,成为单个的氧粒子和汞粒子。单个的粒子不能稳定存在重新组合,每两个氧粒子结合在一起构成一个氧分子,大量的氧分子聚集成氧气,而大量的汞粒子聚集在一起形成金属汞
10.问题思考:在氧化汞受热分解反应中,氧化汞分子分解为氧粒子、汞粒子,而氧粒子、汞粒子又分解为更小的粒子了吗?(没有)
科学上把这种在化学反应中不能再分的粒子叫原子
思考:通过刚才对氧化汞受热反应微观过程的分析,你能说说什么是原子吗? 回答后总结并板书
板书 第二章 第一节 原子
一、原子
1.概念:原子是化学变化中的最小粒子。
指导学生画出概念中的重点词语
为了让学生进一步确信原子的真实存在,可用实物投影仪展示用扫描隧道显微镜拍摄的硅原子照片。
11.问题讨论:前面我们学习了分子的概念,现在又学习了原子的概念,请大家结合图,讨论氧化汞受热是如何发生变化的,变化的实质是什么?结合以下画面讨论
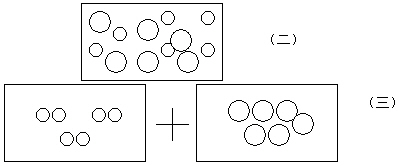
裂变 重新组合
化学反应实质:分子---→原子-------→ 分子 或直接构成 物质(五)
12.汇报与交流:通过交流得出氧化汞受热反应的变化实质:氧化汞受热时氧化汞分子先裂变成单个氧原子、汞原子,然后氧原子、汞原子再重新组合,每两个氧原子结合成一个氧分子,大量的氧分子聚集成氧气,而大量的汞原子直接构成金属汞
13.设问:根据以上的分析、讨论请同学们说出化学反应的实质是什么?
14:评价 讲述:化学反应的实质就是分子裂变成原子,原子重新组合成新的分子或直接构成物质(配合画面(五)讲述,同时板书化学反应实质)
以上多媒体展示的画面应分步出现
15.设问:我们已经知道分子的基本性质,那么原子有哪些性质呢?
指导阅读31页总结出原子的基本性质
16:问题讨论:原子和分子是两种不同的粒子,对照以下表中内容讨论它们有哪些相似性,有什么本质区别,相互间有什么关系。
|
分子 |
原子 |
|
|
相似性 |
||
|
本质区别 |
||
|
相互关系 |
17.小结:师生共同小结本节知识
[板书设计]
第二章第二节 原子
一.原子
1. 概念:原子是化学变化中的最小粒子
重点和难点:原子的组成和相对原子质量概念的形成
教学过程
一.课前布置复习内容和家庭小实验
1.复习内容:初二物理摩擦起电原因
2.家庭小实验:用绸子、毛皮或尼龙布料在塑料棒(或梳子)上摩擦几下,然后把棒靠近纸屑、头发、羽毛等轻小物体上,观察现象。
二.课堂教学过程
1.提出问题引人:"原子是不可再分的粒子"对吗?
19世纪末以前,原子一直被认为是坚硬的、实心的球,是不可分割的。但是到1897年英国物理学家汤姆生发现电子后,就扣开了原子的大门,使人们逐渐认识到原子也有它本身的结构。
2.思考: 原子中有带负电的电子,为什么整个原子不显电性?
3.带着问题阅读发放的小资料
小资料:
英国物理学家汤姆生毕业于英国著名的剑桥大学,1896年起从事阴极射线的研究。阴极射线是在真空的玻璃管内,或者说是在含有及稀薄气体的玻璃管内放电时从阴极放出的射线。1897年,汤姆生在前人研究的基础上,通过实验得出结论:阴极射线是带负电荷的粒子流。1899年汤姆生根据大量实验得出如下结论:1).原子不是不可分割的,借助于快速运动的原子的碰撞、电力、紫外线和热等的作用,都能从原子里扯出带负电的粒子。2).这些粒子具有相同的质量并带有相同的负电荷,无论它们是从哪种原子里得到的,它们都是一切原子的一个组成部分.3).这些粒子的质量小于一个氢原子质量的千分之一。汤姆生把这些粒子称为"电子"。电子带负电,一个电子带一个单位负电核。
继汤姆生发现电子以后,卢瑟福通过大量的实验,1912年春天提出了带核的原子模型,认为原子是由中心的带正电的、体积很小的但几乎集中了原子全部质量的核和在不断运动着的电子所构成。卢瑟福把这个带正电的、质量和整个原子差不多但比原子体积小得多的东西叫做原子核。以后科学实验又证明,原子核是由质子和中子构成的。每个质子带一个单位的正电荷,中子不带电。
4.学生讨论:通过以上资料你能解释为什么原子不显电性吗?总结原子的构成。
5.汇报与交流:汇报交流讨论结果
6.解释:结合学生的回答进行解释:原子是由居于原子中心的带正电的原子核和核外带负电的电子构成的。由于原子核所带电量和核外电子的电量相等,但电性相反,所以整个原子不显电性。
师生共同总结出原子的构成情况
一.原子的构成
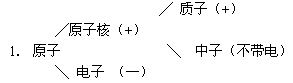
(总结过程中可用恰当的比喻描述原子的构成情况:原子核极小,若把原子比成十层大楼,原子核仅相当于一个樱桃的大小。所以相对来说,原子核外有很大的空间,电子就在这个空间里作高速运动。)
7.学生讨论:
投影:课本33页表2-1几种原子的构成情况
根据以上几种原子的构成情况,你能得出哪些结论?四人一组进行讨论总结。
8.汇报与交流:汇报交流讨论结果。可能的结论有:1)不是所有的原子都含有中子,如氢原子;2)中子数与质子数不一定相等;3)原子核所带的电荷即核电荷数与质子数相等;4)质子数与核外电子数相等。
板书: 2.核电荷数=质子数=核外电子数
所以整个原子不显电性
9.设疑:我们已经知道原子很小但有质量,那么原子的质量有多大呢?

10.讲解:这样小的数字书写、记忆和使用起来都很不方便,就像用吨做单位表示一粒米的质量一样。因此,在国际上,一般不直接用原子的实际质量,而采用不同原子的相对质量-相对原子质量。
11.指导阅读:阅读课本33页相对原子质量的概念并回答问题:
(1)如何理解相对原子质量概念
(2)怎样求算某原子的相对原子质量
12.总结:根据学生的回答加以总结:相对原子质量不是原子的实际质量,它是一个比值,单位是一。某原子实际质量是碳原子实际质量1/12的几倍,这个倍数就是这个原子的相对原子质量
板书

13.讲解:课本最后的附录一就是相对原子质量表,第二章表2-3是常见的相对原子质量的近似植,化学计算采用相对原子质量的近似值。
14.投影:

15.学生讨论:根据以上数据你能得出什么结论?
16.汇报与交流:汇报交流讨论结果
17.小结:根据学生的回答情况进行小结。
从这一组数据可以看出,质子和中子质量大约相等,且都约等于一种碳原子质量的1/12,而电子的质量很小,相对可以忽略不计,因此原子的质量主要集中在原子核上。相对原子质量近似等于质子数加中子数
相对原子质量≈质子数+中子数
18.总结:指导学生总结本节知识
[板书设计]
