 设为首页
设为首页
 加入收藏
加入收藏
教学设计示例一
教学目标:
知识目标:
1.了解定性分析和定量分析的概念。
2.了解常用分析仪器。
3.理解酸碱中和滴定的原理。
4.掌握有关酸碱中和滴定的计算。
能力目标:
1.培养学生从定性角度到定量角度的认知能力。
2.培养学生分析能力和计算能力。
情感目标:
培养学生用辨证的观点看待事物。
教学重点:酸碱中和滴定的原理
教学难点:有关酸碱中和滴定的计算
教学方法:对比教学模式,问题教学模式
教学过程:
【引言】我们在以前的化学学习中,常常需要鉴定物质是由哪些成份组成的?比如氯离子的鉴定,氨离子的鉴定等等。这在化学上叫做定性分析。
当知道了物质的组成成分以后,就需要测定物质中各组成成分的含量,这在化学上叫做定量分析。
【讨论】生活中的定量分析实例。
【小结】在定量分析中我们常常用到酸碱中和滴定,那么什么是酸碱中和滴定?
【讲解】(2)酸碱中和滴定:用已知物质的量浓度的酸(或碱)来测定未知物质的量浓度的碱(或酸)的方法叫做酸碱中和滴定。
【演示图片】常用的滴定仪器:锥形瓶、容量瓶,滴定管、铁架台等。
【小结】酸碱中和滴定在工农业生产中和科学研究中具有很大的实用价值。
【学生活动】写出下列三个反应的化学方程式和离子方程式。
①盐酸和氢氧化钠溶液反应;
②硫酸和氢氧化钠溶液的反应;
③磷酸和氢氧化钠溶液反应。
【提问】上面的反应属于什么反应?
【小结】属于中和反应,具有相同的实验原理。
【提问】它们的实质是什么?
【演示动画】中和反应的实质
【讲解】从上面的演示中我们不难理解中和反应的实质,这个实质不仅可以运用于强酸和强碱的反应,而且同样适用于弱酸或弱碱的反应。例如:氢氧化钠和醋酸,氨水和硫酸的反应等等。
【板书】2.原理
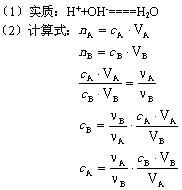
(1)实质:H++OH-===H2O
【提问】根据上面的分析,列出酸碱恰好反应时酸碱物质的量之比与它们计量数之比的比例关系。
【学生活动】① HCl+NaOH===NaCl+H2O
![]()
② H3PO4+3NaOH====Na3PO4+3H2O
![]()
【小结】酸和碱起反应的物质的量之比等于它们的化学计量数之比。
【讨论】如果用A代表酸,用B代表碱,又知c= ![]() ,可得出怎样的结论。
,可得出怎样的结论。
【学生活动】推导后得到
![]() 或
或![]()
【板书】(2)计算式: ![]()
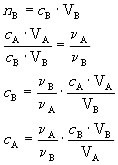
【讲解】从上面的式子可以看出:当一种已知浓度的一元酸与一定体积未知浓度的一元碱反应时,如果测得已知浓度的一元酸在恰好反应时消耗的体积,就可以求出一元碱的物质的量的浓度,这就是中和滴定的计量依据。
【阅读】教材中例题1。
【阅读指导】
①
可利用 ![]() 计算
计算
② 计算过程中要带单位
【板书】(3)如何准确判断中和反应是否恰好进行完全?
【讨论】酸碱中和滴定过程中,溶液pH如何变化?
【讲解】向NaOH溶液中滴加稀盐酸,由于NaOH中OH-被滴入的盐酸中的H+逐渐中和,c(OH-)逐渐减小,溶液pH就逐渐减小,当H+与OH-恰好完全反应时,H++OH-=H2O,溶液呈中性,pH=7。
【提问】pH 的变化本身有没有现象?
【回答】没有现象,因此需要用一种试剂来表示它,这种试剂就叫做指示剂。
【小结】根据指示剂在酸性溶液或碱性溶液中的颜色变化,我们可以判断中和反应是否恰好进行完全。例如,我们可以在待测的NaOH溶液中滴入几滴酚酞试液,溶液变红色,随着盐酸的滴入,当溶液恰好由红色变为无色时,说明盐酸与氢氧化钠反应完全。
【提问】在中和滴定中,除了酚酞,还可以用什么指示剂?
【演示】指示剂的选择和滴定终点的认定
【小结】在强酸滴定强碱的实验中,一般选用的指示剂有甲基橙和酚酞,我们在实验当中最常用的是酚酞,石蕊试液由于色差较小,变色不明显,在滴定时不宜使用。
【阅读】教材“指示剂的变色原理”。
【总结】酸碱中和滴定的原理:H++OH-====H2O
计量依据:酸和碱反应时的物质的量之比等于它们的化学计量数之比。
计算公式: ![]()
滴定终点的判断:选择恰当的指示剂(常用酚酞)。
板书设计:
一、酸碱中和滴定
1.概念
(1)定性分析和定量分析
(2)酸碱中和滴定:用已知物质的量浓度的酸(或碱)来测定未知物质的量浓度的碱(或酸)的方法叫做酸碱中和滴定。
2.原理
(3)如何准确判断中和反应是否恰好进行完全?
教学设计示例二
教学目标
知识目标:
1.使学生初步了解酸碱中和滴定的操作方法。
2.掌握酸碱滴定的误差分析。
能力目标:
1.通过酸碱中和滴定的操作,培养学生的动手能力、观察与判断能力。
2.通过对实验的误差分析,培养学生的计算能力和分析能力。
情感目标:
培养学生实事求是的严谨的科学态度。
教学重点:酸碱滴定的误差分析。
教学难点:酸碱滴定的误差分析。
教学方法:问题教学模式
教学过程:
【复习】酸碱中和滴定的原理是什么?常用的滴定仪器有哪些?
【演示图片】常用滴定仪器的图片,并让学生指认。
【提问】在实际应用时,如何进行酸碱中和滴定的实验呢?这是本节要讨论的主要问题。
【板书】一、中和滴定的操作过程
1.仪器:
酸式滴定管、碱式滴定管,烧杯、锥形瓶、滴定管夹、铁架台
【视频演示】酸碱滴定管
【讲解】碱式滴定管,不能盛放酸性溶液和强氧化性溶液。
酸式滴定管,不能盛放碱液和水解显碱性的溶液。
【视频演示】酸碱中和滴定的实验
【讲解】滴定管的常规操作(检查漏水,润洗,装液,滴定,读数,排除尖嘴处的气泡等)。
【示范】标准盐酸滴定NaOH溶液,边做实验边讲解。
【板书】
2.药品:标准盐酸、酚酞、待测碱液
3.准备工作
① 滴定管
a.检验滴定管是否漏水。
b.洗涤滴定管后要用标准液洗涤2--3次,并排出下端尖嘴处的气泡。
c.注入标准液(或待测液)至“0”刻度上方2-3厘米处。
d.将 溶液调节到“0”刻度(或“0”刻度以下某一刻度)。
e.记录刻度。
② 锥形瓶
a. 只用蒸馏水洗涤,不能用待测液润洗。
b. 用碱式滴定管放一定体积的待测液于锥形瓶中。
4.滴定过程
a. 在锥形瓶的待测液中滴入2-3滴指示剂。
b. 用左手控制酸式滴定管活塞,右手不断按顺时针摇动锥形瓶,眼睛注视锥形瓶中溶液的颜色变化,先快后慢,当接近终点时,应一滴一摇。
c. 终点:最后一滴应刚好使指示剂颜色发生明显的改变而且30秒内不恢复原色,读出末体积,记下读数。
5.数据处理
重复上面的操作2次,记录数据。将上述滴定测得的消耗盐酸溶液的体积取平均值,再代入 ![]() 进行计算,求出NaOH溶液的物质的量浓度。
进行计算,求出NaOH溶液的物质的量浓度。
【提问】判断误差的依据是什么?
【板书】三、中和滴定的有关误差分析
1.判断误差的依据:
![]()
【演示动画】酸碱中和滴定的误差分析
【小结】对于滴定的误差,一般的分析步骤是不正确操作、直接后果、对VA的影响、滴定误差。
【板书】2.分析步骤:不正确操作→直接后果→对VA的影响→滴定误差
【练习】演示误差分析演示文件。
【小结】中和滴定前,必须用滴定液多次润洗滴定管,以确保溶液的浓度不被剩余在滴定管中的水稀释变小;加入指示剂的量控制在2滴~3滴,以避免指示剂消耗酸或碱;临近终点时,滴液要慢,至指示剂变色“不立即”褪去或变为原色即为终点,避免过量。
重视测定结果的复核。即重复实验测定2次以上,取实验平均值。根据计算公式,求出计算值。
板书设计:
一、中和滴定的操作过程
1.仪器:
酸式滴定管、碱式滴定管,烧杯、锥形瓶、滴定管夹、铁架台
2.药品:标准盐酸、酚酞、待测碱液
3.准备工作
① 滴定管
a.检验滴定管是否漏水。
b.洗涤滴定管后要用标准液洗涤2--3次,并排出下端尖嘴处的气泡。
c.注入标准液(或待测液)至“0”刻度上方2-3厘米处。
d.将溶液调节到“0”刻度(或“0”刻度以下某一刻度)。
e.记录刻度。
② 锥形瓶
c. 只用蒸馏水洗涤,不能用待测液润洗。
d. 用碱式滴定管放一定体积的待测液于锥形瓶中。
4.滴定过程
a. 在锥形瓶的待测液中滴入2-3滴指示剂。
b. 用左手控制酸式滴定管活塞,右手不断按顺时针摇动锥形瓶,眼睛注视锥形瓶中溶液的颜色变化,先快后慢,当接近终点时,应一滴一摇。
c. 终点:最后一滴应刚好使指示剂颜色发生明显的改变而且30秒内不恢复原色,读出末体积,记下读数。
二、中和滴定的有关误差分析
1. 判断误差的依据:
![]()
2. 分析步骤:不正确操作→直接后果 →对VA的影响→滴定误差