 设为首页
设为首页
 加入收藏
加入收藏
一、说教材
1.教材的地位和作用
《乙醇》是新课标人教版高中化学必修2第三章《有机化合物》第三节《生活中常见的有机物——乙醇和乙酸》第一课时的内容。根据新课标和新教材学习有机物,学生主要学习的是与日常生活相关的一些重要有机物的组成、结构、主要性质及其在日常生活中的应用等知识。乙醇是是联系烃和烃的衍生物性质的桥梁,在有机物的相互转化中处于核心地位,在学生初中已对乙醇有了初步认识的基础上,教学中注意从结构的角度深化学生对乙醇的认识,使学生了解学习和研究有机物的一般方法。在高中化学必修2的有机部分中对官能团的学习有所体现但没有强化。因此,我认为在本节的教学中我们并不需要去追求知识的系统性,也不需要过多的知识迁移,更系统性的有机物学习将在高二的选修模块《有机化学基础》中完成。
2.学情分析
从知识结构看,学生已经学习了烃的基本知识,对有机化学常见的基本反应类型的有了一定的认识,对生活中较为熟悉的乙醇的一些性质和用途在初中化学学习中也已经有所了解,所以对于进一步学习它的组成和性质,有着较强的求知欲。
目前我所带的班级为我校的平行班,通过高一化学将近一年的学习,同学们也已经具备了一定的实验能力,能在教师的指导下,小组合作完成一些基本实验操作,但部分学生实验观察能力和实验现象的分析能力还有待于进一步的提高,在实验分组时注意将各种不同层次及不同特点学生组合搭配,互相帮扶,鼓励各小组学生主动与老师、同组同学以及组与组之问多交流,形成浓郁的学习研究氛围,完成自主探究合作学习。
从学生的认知心理来看,进入高中阶段,学生的学习思想从“被动接受型”慢慢向“自主学习型”转变。他们学习思维的广阔性、深刻性、逻辑性和创造性明显增加,学习动机比较稳定。
3.教学目标
根据学生已有的知识水平、认知能力以及新课标对本节的建议和教材的要求确立本节的教学目标为:
(1)知识与技能
掌握乙醇的结构、主要性质及用途。了解烃的衍生物和官能团的概念。
(2)过程与方法
通过有关乙醇的实验,学会观察、分析化学实验现象和推理、探究实验结果,并学会对有机物进行科学探
究的基本思路和方法。
(3)情感、态度与价值观
在合作探究过程中,体验科学探究的过程,养成团结合作的品质。
通过学习乙醇的用途,感受化学与生活、社会的密切关系,养成关注化学相关社会热点问题的习惯。
4.教学重点、难点
(1)教学重点乙醇分子结构的推断和乙醇的化学性质
(2)教学难点乙醇的化学性质及与结构之间的关系
二、说教法
根据我校学生的实际情况,我设计了如下教学方法:
1.实验探究法:充分发挥学生主体作用,将教材中演示实验改为学生实验(如乙醇与金属钠的实验、乙醇的催化氧化实验等),调动学生的内在动力,促使学生积极主动的探索知识。
2.讲授法:随着教学方法的改革,新教法不断出现的同时,讲授法也在不断地完善。而且不论是哪一种
教学方法,都离不开教师的讲解、点评、总结。
3.多媒体辅助教学:采用多媒体模拟微观演示,多角度立体展示物质的微观结构,激发学生的学习兴趣。
三、说学法
采用探究实验,利用鲜活实验现象,使学生带着问题主动探求答案,提高学生实验现象的观察分析能力。同时,运用类比推理的方法,通过联想和类比、填表等方式引导学生综合利用已学习过的烃类的相关知识,进行归纳和总结,从而自己得出相关结论,让学生成为学习的真正主体,感受自主学习的乐趣。
四、教学过程
1.导入新课
学生在初中已经学习过乙醇的化学式为:C:H,OH,,结合之前学到烃的相关知识,学生很容易得出
C:H,OH应为乙醇的结构简式,那么乙醇的结构到底是怎样的呢?
2.乙醇的分子结构
【学生活动】由学生根据已知的乙醇的结构简式推测乙醇的结构式和分子式,同时对比结构式、结构简式、分子式的差别。
【教师提示】注意考虑有机物中碳原子成键特点及烃分子的结构特点。

【活动点评】点评结构简式、结构式以及分子式的书写。实物投影仪
【投影演示】电脑投影展示乙醇分子的结构式、球棍模型和比例模型。
【教师启发】对比乙醇和乙烷的分子式和结构式,分析乙醇从结构上看与乙烷的关系?
【学生回答】乙醇可以看成时CH3CH3分子中的一个H被一OH取代衍变而来。
引出“烃的衍生物”及“官能团”的相关概念。
3.乙醇的物理性质
【学生总结】乙醇的物理性质
4.乙醇的化学性质
a.乙醇和Na反应
【探究活动l】1.观察金属钠的保存。(提示:煤油的主要成分为多种液态烃的混合物)
2.在两个烧杯中分别加入等体积的乙醇和水,将同样大小的两块金属钠分别放人烧杯中。
【探究任务】1.观察实验现象,并将两个烧杯中的反应现象进行对照,填写下表;
2.推测乙醇与钠反应产物;(提示:乙醇和水的结构式)

【得出结论】学生写出钠与乙醇反应的化学方程式,学生教师共同评价。
【思考】1.此反应的本质、反应类型?
练习写出其它活泼金属K、Ca等与乙醇反应的化学方程式。
2.对比乙醇、水与钠反应,它们反应现象的剧烈程度为什么不一样?
乙醇结构中乙基和水分子中的氢原子对氢氧键的影响看来还是不一样的,所以反应速率以及剧烈程度明显不同。那么由这个讨论实际上是为我们后面的学习有机物官能团之间的相互影响而导致性质差异这个特点埋下伏笔。
【动画演示】乙醇与钠的反应,并分析其中量的关系。
【学生总结】乙醇与生成氢气的物质的量之比为2:1
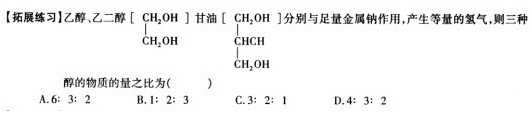
【课外探究】在实验过程当中,部分同学发现,开始反应时钠沉在乙醇底部,而随着反应的进行,钠块慢慢浮起,这与钠的密度大于乙醇密度是相悖的,感兴趣的同学可将此作为课外活动的课题进一步进行探究。
b.乙醇的氧化反应
【过渡】对于大家来说,乙醇最熟悉的性质就是燃烧,而这个性质已经被应用做汽车燃料。它清洁环保,在提倡低碳生活的今天更要大力推广使用乙醇汽油。
① 燃烧CH3cH20H+302![]() 2CO2+3H2O
2CO2+3H2O
② ②乙醇的催化氧化
【探究活动2】乙醇的催化氧化:将灼热的弯曲成螺旋状的铜丝伸入盛有无水乙醇的试管中,反复多次。观察
实验现象,重点观察铜丝颜色的变化并小心闻试管中液体气味的变化。
【动画演示】催化氧化反应过程中乙醇的结构变化。
【学生活动】学生归纳实验现象,观看动画演示并试着写出反应方程式。
【教师归纳】纠正并写出正确的反应方程式。
【回归生活】工人师傅在焊接铜线头时的操作。
c.乙醇与强氧化剂重铬酸钾、高锰酸钾溶液的反应
【情境引入】展示图片,说明酒后驾车的危害并介绍交警检验酒后驾驶的方法。
【原理解释】乙醇与强氧化剂反应,现象为:酸性重铬酸钾溶液:橙红色一绿色酸性高锰酸钾溶液:褪色
5.乙醇的用途
小结:和学生共同归纳本节的知识,重点归纳乙醇的化学性质,用电脑模拟演示,使学生加深理解并巩固所学的知识。
6.课堂练习:针对本节课的知识,考虑不同层次学生的需求,按照循序渐进、由浅人深的原则设置一些有梯度的习题,使本节课的重点知识进一步强化,如:
(1)下列关于酒精的说法正确的是
①各种料酒中都含有酒精②酒精有加快人体血液循环和使人兴奋的作用③白酒若长时间放置,保存不好会产生有毒物质,不能饮用④在炒菜时加入些酒和醋可以使菜的味道更香⑤酒精在人体内不需经消化作用可直接被肠胃吸收
A.只有①④⑤ B.只有①③⑤ c.①③④⑤ D.①②③④⑤
(2)乙醇分子结构中各种化学键如下图所示,判断乙醇在各种反应中断键的部位
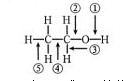
a.与活泼金属反应——断裂 b.在Cu或Ag催化下和O:反应键——断裂
(3)质量为a g的铜丝,在空气中灼烧变黑,趁热放人下列物质中,铜丝变为红色,而且质量仍为a g的是
( )
A.盐酸 B.一氧化碳 C.硝酸 D.乙醇
【课后拓展】1.利用生活中常见材料制作乙醇分子模型。
2.根据收集的有关酒的资料,结合老师的简单分类和本节学习的知识,选择研究小课题(酒的发展史,酒的酿造、酒文化,酒的用途等),进行探究,并将研究成果收集在学生的个人成长记录袋中。
五、板书设计

六、课堂教学评价
过程性评价:课堂参与积极性评价、操作实验能力的评价、化学用语规范表达的评价
终结性评价:习题检测评价(课堂练习及作业分层次)、课后研究论文放入学生成长记录袋。评价方式多元化:学生自评、组内同学互评、教师点评
|